2. 浙江省森林资源监测中心, 浙江 杭州 310020;
3. 杭州鸿森林业调查规划设计有限公司, 浙江 杭州 310020
2. Zhejiang Provincial Forest Resources Monitoring Center, Hangzhou, Zhejiang 310020, China;
3. Hangzhou Hong Forest Industry Survey Planning and Design Co., Ltd., Hangzhou, Zhejiang 310020, China
湿地是地球最大的碳库之一,碳储量约为7.70×1010 t,约为温带森林和热带雨林生态系统碳储量之和的1.35倍,占到陆地生物圈碳素的35.0%,其固碳能力远高于其他类型的生态系统。因此,湿地在调节陆地生态系统全球碳平衡方面具有极其重要的意义[1]。湿地生态系统的大部分碳储存在土壤中。湿地土壤固碳能力的影响因素包括气候因子[2]、凋落物数量以及土壤理化性质等[3],这些因素也决定着湿地土壤微生物多样性格局和固碳能力[4]。研究表明,不同的湿地土地利用方式会导致植被类型和土壤理化性质的变化,从而影响湿地土壤有机碳库和土壤碳储量。段晓男等[5]的调查表明我国湖泊湿地的固碳速率为5~72 g/(m2·a),这种差异也与湿地土地利用方式密切相关。作为生物地球化学循环的“引擎”,微生物通过分解代谢和合成代谢驱动湿地土壤的碳循环,是湿地生态系统的重要组成部分,在湿地土壤固碳中发挥着积极作用[6]。微生物碳固定途径主要有卡尔文循环、还原三羧酸循环、还原乙酰辅酶A途径、3-羟基丙酸双循环、3-羟基丙酸/4-羟基丁酸循环和二羧酸/4-羟基丁酸循环这6种[7]。土壤微生物碳固定正是在多种固定途径下,微生物将碳源转化为自身物质的过程,能够促进土壤碳增汇和碳固定。研究[8]发现,微生物的固碳能力取决于生态系统的类型,进一步证实了微生物群落与湿地土地利用方式之间的密切关系。因此,有必要研究不同土地利用方式下湿地土壤微生物的固碳差异。
长兴仙山湖国家湿地公园是华东地区自然湿地与人工湖泊湿地的典型代表,也是长三角地区最具有生物多样性的湿地生态系统之一。蒋敏等[9]对仙山湖国家湿地公园湿地进行类型概述和梯度分析,根据拉姆萨尔湿地分类法,利用集群分析将仙山湖湿地划分为不同湿地类型。然而,该湿地不同土地利用方式导致其土壤微生物固碳能力发生变化的报道较少。为此,本文以仙山湖湿地公园内的11种土地利用方式的表层土壤作为研究对象,以高通量测序技术对样地土壤细菌固碳效应进行比较分析,探究不同土地利用方式下的微生物群落和固碳能力的信息,为仙山湖湿地生态系统资源的可持续利用提供参考,并为湿地资源的保护提供理论依据。
1 材料与方法 1.1 研究区概况仙山湖国家湿地公园(30°52′08″—30°55′25″N, 119°33′51″—119°38′38″E),地处江苏、浙江、安徽三省交界处,属太湖水系,地处太湖上游,土地总面积2 269.2 hm2,其中湿地面积达1 395.3 hm2,占土地面积的61.5%。仙山湖国家湿地公园森林面积约753.1 hm2。该湿地公园地处中亚热带季风气候区,湖区水面广阔,森林繁茂,具有冬暖夏凉、昼夜温差小的小气候条件,平均年降水量1 309 mm,年平均气温13.9 ℃。
1.2 样品采集与前处理结合仙山湖国家湿地公园内植物群落类型,选取竹林T1,苗圃T2,阔叶林T3,人工松树林T4,莎草沼泽T5,芦苇沼泽T6,人为干预的沿岸植被(水岸草丛)T7,人为干预的河道沿岸森林(落羽杉树林)T8,人为干预的河道沿岸森林(柳树沼泽)T9,天然沿岸森林(水岸柳林)T10,芦苇和柳树沿岸植被11种不同植物群落T11共计11个样区作为固碳增汇样地并采集土样。在调查中对样地进行GPS定位,记录采样点的经纬度坐标、植被类型、土地利用方式等相关信息,通过走访附近村民发现了仙山湖11种植物群落的样地类型演变过程,演变过程详见表 1。每个采样区内,按五点取样法在0—20 cm土层采集土壤,混合为1个土样,同时,采用环刀法测定土壤容重。每个采样区设置3次重复。去除土壤中的动植物残体和碎石等杂物,将土样分为3份装入无菌袋密封,用干冰保存带回实验室,(1份新鲜土样贮存在-80 ℃用于微生物信息和宏基因组测试; 1份在室内自然风干后用于土壤性质的分析; 另1份贮存在4 ℃用于微生物碳利用效率的测定)。土壤采样时间为2022年7月16日。
|
|
表 1 仙山湖碳汇样地分类及演变过程 Table 1 Classification and evolution process of carbon sink plots in Xianshan Lake |
土壤性质的分析方法:土壤全氮(TN)经过H2SO4消煮后,采用自动定氮仪法测定,全磷(TP)采用H2 SO4酸溶—钼锑抗比色法测定,土壤有机质含量的测定采用重铬酸钾氧化—分光光度法。土壤中全钾(TK)采用氢氧化钠熔融法,利用AA-6880分光光度计测定,土壤pH值的测定采用离子选择电极法(土水比为1∶2.5),利用IS128 C pH计测定。采用18O-H2O标记法测定土壤微生物碳利用效率[10]。
1.4 高通量测序以及固碳功能基因检测土壤样品的总基因组DNA通过FastDNA SPIN Kit for Soil MP Biomedicals, USA试剂盒提取,每个样本进行3个重复,PCR产物用1.5%琼脂糖凝胶电泳检测DNA浓度和纯度。采用细菌通用引物515F 5′-GTGCCAGCMGCCGCCG-3′和907R 5′-CCGTCAATTCMTTTRAGTTT-3′扩增16 S rRNA基因的V3-V4高变区,PCR反应条件:95 ℃,3 min;95 ℃,30 s;56 ℃,30 s;72 ℃,1 min;40次循环; 72 ℃,8 min。PCR反应体系:正、反向引物10 μmol/L各2 μl, 2×Taq Master Mix Dye Plus 25 μL, DNA模板2 μl, ddH2O 20 μl。PCR反应完成后,将3个技术重复中的产物合并,并在琼脂糖凝胶上进行电泳实验。将目标位置的条带切割,并使用DNA凝胶提取试剂盒进行核酸回收。使用微核酸分析仪测量回收产物的核酸浓度,然后调整每个样品的浓度以进行双端测序。采用浙江大学农业生物与环境科学分析中心的Ion GeneStudio S5(Thermo Fisher Scientific, Walthm, USA)进行测序[11]。
宏基因组测序首先通过Covaris©M220聚焦超声波破碎仪将DNA片段化处理,打断为400 bp左右长度的片段,然后采用NEXTFLEXTM公司Rapid DNA-Seq Kit试剂盒构建PE文库,使用HiSeq 3000/4000 PE Cluster Kit试剂盒进行桥式聚合酶链式反应,通过质量检测后,使用Illumina HiSeq 2000进行测序。本研究的宏基因组测序工作由上海美吉生物医药科技有限公司完成。
1.5 数据统计和分析土壤有机碳储量计算公式为:
| $ S_{\text {Cstock }}=S_{\text {Cron }} \cdot B_D \cdot H $ | (1) |
式中:SCstock为单位面积有机碳的储量(t/hm2); SCcon为土壤有机碳含量(g/kg); BD为土壤容重(g/cm3); H为土层厚度(cm)。
Spohn提出使用18O-H2O-DNA法,测定微生物在短期内的生长速率和呼吸速率,从而计算出微生物CUE,计算公式为:
| $ \mathrm{DNA}_p=O_t \times \frac{\mathrm{at} \%_e}{100} \times \frac{100}{\mathrm{at} \%_{\mathrm{swr}}} \times \frac{100}{31.21} $ | (2) |
| $ \mathrm{CUE}=\frac{\mathrm{DNA}_p \times \mathrm{C} / \mathrm{DNA}}{\mathrm{DNA}_p \times \mathrm{C} / \mathrm{DNA}+\mathrm{CO}_2} $ | (3) |
式中:DNAP表示微生物DNA产量(μg/g); Ot为干燥DNA提取物中的总氧含量(μg/g); at%e为标记样品的18Oat%(18O丰度)与非标记样品的18Oat%(18O天然丰度)之间的差异; at%swr为土壤水的18O丰度; 31.21为DNA中氧气的平均百分比; C/DNA为微生物生物量碳含量(μg/g)与DNA含量(μg/g)的比值; CO2为微生物呼吸的碳通量(μg/g)。
采用SPSS 24.0 IBM软件,运用(One-Way ANOVA)检验差异显著性进行单因素方差分析; 使用Excel 2003软件对数据进行处理与统计,分析出不同样品的土壤性质、有机碳储量和固碳功能基因。采用Pearson相关性分析细菌门和碳固定功能基因丰度与环境因子之间的关系,使用OriginPro 2021 Origin Lab软件绘制有机碳储量、门水平和属水平上的土壤微生物群落、固碳基因丰度的柱状图及其与环境因子的相关性热图。
2 结果与分析 2.1 不同土地利用方式下土壤性质通过比较不同土地利用方式下土壤的全氮、全钾、全磷含量和pH值及有机碳储量,分析不同土壤性质的差异。结果显示土壤性质受土地利用方式影响差异显著(p < 0.05,表 2,图 1)。11种土地利用方式中土壤有机碳储量顺序为:莎草沼泽>天然沿岸森林>竹林>苗圃>人为干预的河道沿岸森林(落羽杉树林)>人工松树林>阔叶林>人为干预的沿岸植被>人为干预的河道沿岸森林(柳树沼泽)>芦苇沼泽>芦苇和柳树沿岸植被。不同土地利用方式的全氮含量0.19~0.60 g/kg,不同土地利用方式的全钾含量0.22~2.22 g/kg,不同土地利用方式的全磷含量0.02~0.38 g/kg。
|
|
表 2 不同土地利用方式下土壤因子 Table 2 Soil factors under different land use patterns |

|
注:数据为平均值±标准差(n=3); 不同字母表示不同土地利用方式的差异显著性(p < 0.05)。下同。 图 1 不同土地利用方式对土壤有机碳储量的影响 Figure 1 Impacts of different land use patterns on soil organic carbon storage |
莎草沼泽土壤TN为0.58±0.02 g/kg,土壤有机碳储量为38.68±0.56 t/hm2,约占湿地土壤总储量的17.97%,其TN含量和有机碳储量在11个样地土壤中达到峰值。天然沿岸森林土壤TN(0.55±0.02 g/kg)和有机碳储量(22.59±0.85 t/hm2)仅次于莎草沼泽,且显著高于其他土地利用方式(p < 0.05)。线性回归分析两者的相关性表明,土壤有机碳储量与TN之间有着极强的正向相关性(p < 0.05)。天然沿岸森林土壤TK为2.20±0.02 g/kg,显著高于其他土地利用方式; 天然沿岸森林土壤TP为0.34±0.04 g/kg,显著高于其他土地利用方式; 保护区土壤pH值波动范围为4.45~6.98,整体为偏酸性土壤。
2.2 不同土地利用方式下微生物物种组成分析为了探究微生物菌群结构与土壤固碳作用相关性,以仙山湖国家湿地公园11种不同植物群落的生境土壤(0—20 cm)作为研究对象,利用高通量测序技术对土壤细菌优势菌门进行分析。测序结果表明共有207 537条基因序列,这些序列涵盖了26 150个OTU。它们分属于细菌的49个门147个纲3 709个目5 097个科8 217属。图 2a表示不同土地利用方式下土壤微生物在门水平上优势菌门(OTUs>1%)。①门水平分析结果显示,变形菌门、拟杆菌门、酸杆菌门、绿弯菌门在仙山湖湿地植物群落类型土壤中占主导地位(图 2a)。在7个湿地土壤样品中,优势菌门为变形菌门(Proteobacteria, 9.48%~56.39%),蓝藻门(Cyanobacteria, 4.72%~51.56%),拟杆菌门(Bacteroidetes, 8%~17.42%),绿弯菌门(Chloroflexi, 2.77%~5.93%),酸杆菌门(Acidobacteria, 1.5%~8.25%),厚壁菌门(Firmicutes, 1.37%~3.32%)和硝化螺旋菌门(Nitrospirae, 1.02%~1.2%)。这些门类构成了总序列的86.7%~88.8%。变形菌是莎草沼泽和天然沿岸森林碳封存微生物群落中的主要细菌群(图 2a)。与莎草沼泽相比,天然沿岸森林的变形菌相对丰度下降了35.72%,固碳能力也有所下降。然而,在4个旱地植物群落类型土壤样本中,主要的微生物门包括酸杆菌门(Acidobacteria, 34.41%~63.54%),变形菌门(Proteobacteria, 9.45%~20.66%),绿弯菌门(Chloroflexi, 4.09%~13.03%),泉古菌门(Crenarchaeota, 3.97%~6.21%),放线菌门(Actinobacteria, 2.11%~8.18%),蓝菌门(Cyanobacteria, 1.78%~14.81%),芽单胞菌门(Gemmatimonadetes, 1.21%~2.94%),浮霉菌门(Planctomycetes, 1.21%~2.95%)和拟杆菌门(Bacteroidetes, 1.12%~6%),这些门类构成了总序列的87.9%~90.5%。该类样地变形菌的相对丰度远低于莎草沼泽和天然沿岸森林,而酸杆菌的相对丰度高于两个湿地群落。②属水平分析结果显示(图 2b), 4个旱地植物群落类型的主要优势菌属为Candidatus Solibacter, Rhodoplanes, Burkholderia, Mycobacterium和Candidatus Koribacter,而7个湿地植物群落类型的主要优势菌属为Geobacter, Bacteroides, Adyrhizobium, Dok59, Candidatus Methylomirabilis和Flavobacterium。同时,4类变形菌(α-, β-, γ-and δ-Proteobacteria)在湿地固碳微生物群落中发挥非常重要的作用,莎草沼泽β-Proteobacteria的相对丰度(13.80%)高于天然沿岸森林(4.74%),但是低于落羽杉树林(15.61%); 莎草沼泽δ-Proteobacteria的相对丰度(33.54%)低于天然沿岸森林(51.61%)。芦苇沼泽的α-Proteobacteria相对丰度(25.91%)显著高于其他湿地群落。可见在不同土地利用方式下,土壤中的细菌组成在属水平上存在着显著差异。这些结果进一步揭示了土地利用方式对土壤固碳微生物群落结构的影响。

|
图 2 不同土地利用方式下土壤微生物群落组成 Figure 2 Soil microbial community composition under different land use types |
比较不同土地利用方式下的微生物碳利用效率(图 3),结果显示湿地植物群落类型土壤微生物的碳利用效率普遍高于旱地植物群落类型。莎草沼泽土壤微生物碳利用效率为0.66,为天然沿岸森林的1.13倍,显著高于其他土地利用方式(p < 0.05)。竹林,苗圃两个旱地植物群落类型的土壤微生物碳利用效率差异性较小。人为干预的沿岸植被土壤微生物碳利用效率为0.44,显著低于其他湿地植物群落类型(p < 0.05)。相关性分析结果表明, 11种土地利用方式的土壤有机碳储量年增量开4次方的值与土壤微生物碳利用效率的变化趋于几乎一致,两者具有直接相关性,土壤微生物菌群对土壤有机碳储量增加值具有正相关性。

|
图 3 不同土地利用方式对土壤微生物碳利用效率的影响 Figure 3 Effects of different land use types on carbon use efficiency |
采用微生物宏基因组测序技术对不同土地利用方式的微生物固碳功能基因进行比较分析(图 4),结果显示,莎草沼泽的ascA基因、ascC基因、pccA基因、cdaR基因、frdA基因、smtA基因显著高于其他土地利用方式,天然沿岸森林的korA基因、aclB基因、ascB基因、accA基因显著高于其他土地利用方式。参与卡尔文循环的rbcL基因丰度在T1至T44个旱地植物群落类型中较高,其固碳基因的增长趋势一致,4种土地利用方式中固碳基因丰度皆表现为:竹林 < 苗圃 < 阔叶林 < 人工松树林; 而人工松树林和芦苇沼泽在还原乙酰辅酶A途径,3-羟基丙酸循环、3-羟基丙酸/4-羟基丁酸循环和二羟基/4-羟基丁酸循环途径中,固碳基因丰度未呈现显著差异。
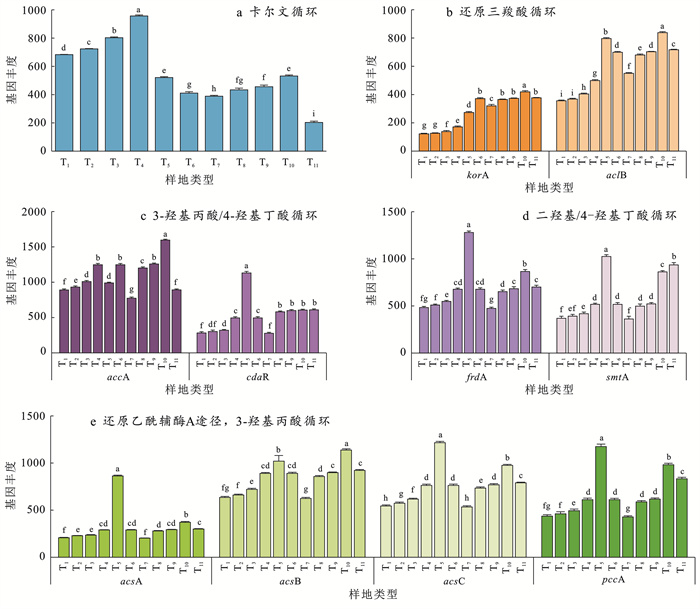
|
图 4 不同土地利用方式固碳功能基因丰度 Figure 4 Abundance of carbon fixation genes in different land use type |
土壤碳循环相关功能基因与环境因子间的相关性分析如图 5a所示。结果表明,固碳功能基因丰度与有机碳储量、总氮、总钾呈正相关关系。其中,ascA, ascC, cdaR和frdA基因丰度与有机碳储量呈极显著正相关(p < 0.01), acsA, acsC, pccA, frdA和smtA基因丰度与总氮呈现正相关(p < 0.01), pccA和smtA基因丰度与总钾呈极显著正相关(p < 0.01)。各基因与总磷和pH值的相关性较弱,而rbcL与环境因子呈负相关,korA和aclB基因与环境因子之间相关性不高,但acsA, acsC, pccA, cdaR, frdA和smtA基因与环境因子之间相关性较强。仙山湖湿地土壤理化因子的相互作用共同影响了土壤固碳微生物群落的特征。固碳微生物的优势菌群受土壤pH值和有机碳储量的影响显著。进一步分析属水平优势菌群与环境因子的关系(图 5b),结果表明,土壤细菌优势菌门中变形菌门土壤环境极为敏感,与有机碳储量和总氮呈显著正相关,与总钾呈极显著正相关。放线菌门对环境变化的敏感性较低。绿湾菌门和pH值呈显著正相关,酸杆菌门则与其呈现显著负相关。结果表明,仙山湖湿地的碳储量与这4类细菌的相对丰度比密切相关。

|
图 5 环境因子与固碳功能基因(a)和土壤细菌门相关性热图(b) Figure 5 Correlation heat map between environmental factors and carbon sequestration functional genes (a) and soil bacterial phylum (b) |
湿地固碳能力和土壤理化性质密切相关,大量研究报道显示,不同土地利用方式会改变土壤全氮、pH值和含水量[12],从而影响土壤有机碳储量[13]。本研究发现,农田到湿地沼泽的衍变比农田到沿岸森林的衍变更可取,以莎草沼泽为代表的湿地条件下更利于植物的恢复和生长,以及土壤碳的代谢和固定,这与Tan等[14]的结论一致。莎草沼泽湿地土壤底物中的氮含量较高,微生物更容易大量聚集,容易形成较为稳定的土壤有机质[15],此外较高的氮含量可能会降低土壤pH值,抑制土壤中微生物活性,降低有机碳的分解速率[16]。土壤含水量高也是莎草沼泽高碳储量的关键因素,当水深长期超过一定深度后,水上森林和芦苇的根部无法呼吸会导致大量死亡,有机质随水体流向土壤[17]。丁俊男等[18]对塔河固奇谷湿地的研究也表明,沼泽化湿地类型具有较强的蓄水能力,增强了土壤中固碳微生物的活性,对土壤有机碳的积累具有积极的作用。
3.2 仙山湖湿地公园不同土地利用方式对土壤微生物类群的影响微生物群落的结构和功能受到湿地类型演变、植被类型、土壤理化性质的影响。本研究发现,变形菌门、酸杆菌门、拟杆菌门和绿弯菌门是湿地植物群落类型的优势菌门,酸杆菌门和变形菌门在旱地植物群落中占主导地位(图 2a), Yuan等[19]研究表明这些菌门具有碳固定能力。变形菌是全球碳循环中的重要微生物,参与土壤有机质的降解和碳、氮的生物地球化学循环[20],是仙山湖莎草沼泽和水岸柳林主要的固碳细菌类群。这可能是由于该样地的土壤有机碳储量较高,相关研究表明变形菌门偏好在养分含量高的土壤环境中生存,且丰度与土壤有机质和全氮含量显著相关。Zhang[21]等人在青海湖湿地的研究表明,变形菌是青海湖沼泽和河源湿地碳封存菌群中的主要细菌类群; Ma[22]等人研究了呼伦湖流域4种湿地类型的碳封存微生物群落,发现变形菌是不同湿地类型中最重要的固碳细菌,他们的发现与本研究结论一致。通过对相关性热图的分析,研究发现土壤pH值与酸杆菌门的丰度存在显著负相关关系,这与大部分研究发现一致[23]。酸杆菌在仙山湖旱地的再生阔叶林中占主导地位,因为酸杆菌会降解森林土壤中的植物残体并利用碳源提升森林土壤的固碳能力,对维持土壤健康和碳循环方面起着至关重要的作用[24]。拟杆菌可以增加土壤有机碳的含量,为土壤酶活性提供能量,本研究中,拟杆菌的相对丰度在水岸草丛的土壤中含量最高,因为拟杆菌主要生活在水环境中,而水岸草丛具有较高的水位。绿弯菌门参与纤维素、木聚糖和几丁质等多糖的水解,在人工松树林和落羽杉树林的相对丰度较高。
湿地生态系统中固碳微生物的群落组成在属水平上存在差异。α-Proteobacteria在芦苇沼泽的相对丰度高于莎草沼泽,因为α-Proteobacteria受到氧气和芦苇根系渗出物的影响,在芦苇沼泽固氮固碳中起着必要的作用[25]。莎草沼泽和水岸柳林土壤中β-Proteobacteria相对丰度显著高于其他湿地植物群落,β-Proteobacteria在固碳和有机质矿化上起到重要作用[26],这与李子旭等[27]的发现相似。本研究结果显示,莎草沼泽和芦苇沼泽土壤的变形菌含量和属水平明显高于其他土壤,这也可能是导致沼泽湿地土壤有机质含量较高的因素之一。
3.3 仙山湖湿地公园不同土地利用方式对微生物固碳能力的影响土壤微生物驱动着养分循环,其固碳功能基因丰度反映了固碳能力的大小。固碳基因丰度越高,微生物对土壤碳汇贡献越大。本研究发现,参与二羟基/4-羟基丁酸循环的frdA基因、smtA基因和还原乙酰辅酶A途径的ascA基因、ascC基因和pccA基因均表现为在莎草沼泽土壤丰度最高,参与还原三羧酸循环的korA基因和aclB基因均表现为在水岸柳林土壤丰度最高,表明固碳微生物在莎草沼泽和水岸柳林固碳潜力较强,对土壤碳汇的贡献较大。Campbell等对aclB等功能基因构建克隆文库发现变形菌是利用还原三羧酸循环固定CO2的主要微生物类群[28],在本研究中变形菌门是莎草沼泽和水岸柳林的优势菌门,其根际土壤微生物固碳潜力更高,从而调控aclB基因的高表达。卡尔文循环在调节大气CO2浓度方面发挥重要作用,是碳固定的最主要途径,rbcL基因可作为分子标记用来反映微生物的固碳能力[29]。本研究结果发现在碳固定过程中卡尔文循环的rbcL基因丰度在阔叶林和人工松树林土壤较高,显著高于莎草沼泽等湿地土壤,这与赵姣等[30]对黄土高原复垦土壤的研究结果一致,在旱地植物群落中阔叶林的土壤微生物有较强的固碳能力。
4 结论湿地生态系统中,不同土地利用方式下土壤固碳微生物群落与功能基因变化影响湿地微生物固碳能力。土壤有机碳储量和全氮是调控仙山湖固碳微生物类群和固碳基因丰度的主导因子。莎草沼泽下土壤有机碳储量、全氮含量和微生物碳利用效率最高,并且其固碳功能基因(ascA基因、ascC基因、pccA基因、cdaR基因、frdA基因和smtA)显著高于其他土地利用方式。莎草沼泽作为重要的碳汇,具有较高的碳储备能力。仙山湖湿地类型不同区域下固碳微生物的优势菌群差异较大,莎草沼泽和水岸柳林固碳微生物优势菌群为变形菌,酸杆菌为再生阔叶林主要固碳菌群。
| [1] |
孙欣. 灌木扩张对三江平原沼泽湿地植物多样性及其固碳能力的影响[D]. 黑龙江哈尔滨: 东北林业大学, 2024. Sun Xin. Effects of shrub expansion on plant diversity and carbon sequestration capacity of marsh wetlands in the Sanjiang Plain [D]. Harbin, Heilongjiang: Northeast Forestry University, 2024. |
| [2] |
Saintilan N, Rogers K, Kelleway J J, et al. Climate change impacts on the coastal wetlands of Australia[J]. Wetlands, 2019, 39(6): 1145-1154. DOI:10.1007/s13157-018-1016-7 |
| [3] |
Gentile R, Vanlauwe B, Six J. Litter quality impacts short-but not long-term soil carbon dynamics in soil aggregate fractions[J]. Ecological Applications, 2011, 21(3): 695-703. DOI:10.1890/09-2325.1 |
| [4] |
Mlewski E C, Saona L A, Boidi F J, et al. Exploring soil bacterial diversity in relation to edaphic physicochemical properties of high-altitude wetlands from Argentine Puna[J]. Microbial Ecology, 2023, 87(1): 6. |
| [5] |
段晓男, 王效科, 逯非, 等. 中国湿地生态系统固碳现状和潜力[J]. 生态学报, 2008, 28(2): 463-469. Duan Xiaonan, Wang Xiaoke, Lu Fei, et al. Carbon sequestration and its potential by wetland ecosystems in China[J]. Acta Ecologica Sinica, 2008, 28(2): 463-469. DOI:10.3321/j.issn:1000-0933.2008.02.002 |
| [6] |
Liang Chao, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. DOI:10.1038/nmicrobiol.2017.105 |
| [7] |
刘洋荧, 王尚, 厉舒祯, 等. 基于功能基因的微生物碳循环分子生态学研究进展[J]. 微生物学通报, 2017, 44(7): 1676-1689. Liu Yangying, Wang Shang, Li Shuzhen, et al. Advances in molecular ecology on microbial functional genes of carbon cycle[J]. Microbiology China, 2017, 44(7): 1676-1689. |
| [8] |
Peng Wentao, Wang Yan, Zhu Xiuxiu, et al. Distribution characteristics and diversities of cbb and coxL genes in paddy soil profiles from Southern China[J]. Pedosphere, 2021, 31(6): 954-963. DOI:10.1016/S1002-0160(21)60027-9 |
| [9] |
蒋敏, 朱培, 孙勇, 等. 仙山湖国家湿地公园湿地类型分析及生态系统研究[J]. 华东森林经理, 2017, 31(3): 42-45. Jiang Min, Zhu Pei, Sun Yong, et al. Wetland type analysis and ecosystem research of Xianshanhu National Wetland Park[J]. East China Forest Management, 2017, 31(3): 42-45. |
| [10] |
Spohn M, Klaus K, Wanek W, et al. Microbial carbon use efficiency and biomass turnover times depending on soil depth: Implications for carbon cycling[J]. Soil Biology and Biochemistry, 2016, 96: 74-81. DOI:10.1016/j.soilbio.2016.01.016 |
| [11] |
曾慧慧, 蒋敏, 赵明星, 等. 仙山湖国家湿地公园湿地与旱地土壤细菌群落结构特征比较[J]. 微生物学通报, 2024, 51(6): 1983-1994. Zeng Huihui, Jiang Min, Zhao Mingxing, et al. Comparison of bacterial community structure between wetland and dryland in Xianshan Lake National Wetland Park[J]. Microbiology China, 2024, 51(6): 1983-1994. |
| [12] |
Xu Chonghua, Xu Xia, Ju Chenghui, et al. Long-term, amplified responses of soil organic carbon to nitrogen addition worldwide[J]. Global Change Biology, 2021, 27(6): 1170-1180. DOI:10.1111/gcb.15489 |
| [13] |
Solomon D, Lehmann J, Kinyangi J, et al. Long-term impacts of anthropogenic perturbations on dynamics and speciation of organic carbon in tropical forest and subtropical grassland ecosystems[J]. Global Change Biology, 2007, 13(2): 511-530. DOI:10.1111/j.1365-2486.2006.01304.x |
| [14] |
Tan Sijia, Jiang Lijuan, Liu Jingyi, et al. Rhizosphere microorganisms and soil physicochemical properties of restored wetland plant communities at cutting slash of populus deltoides in Dongting Lake[J]. Wetlands, 2023, 43(5): 48. DOI:10.1007/s13157-023-01696-1 |
| [15] |
Mao Qinggong, Lu Xiankai, Mo Hui, et al. Effects of simulated N deposition on foliar nutrient status, N metabolism and photosynthetic capacity of three dominant understory plant species in a mature tropical forest[J]. Science of the Total Environment, 2018, 610: 555-562. |
| [16] |
韩广轩, 李隽永, 屈文笛. 氮输入对滨海盐沼湿地碳循环关键过程的影响及机制[J]. 植物生态学报, 2021, 45(4): 321-333. Han Guangxuan, Li Juanyong, Qu Wendi. Effects of nitrogen input on carbon cycle and carbon budget in a coastal salt marsh[J]. Chinese Journal of Plant Ecology, 2021, 45(4): 321-333. |
| [17] |
肖烨, 黄志刚, 武海涛, 等. 三江平原典型湿地类型土壤微生物特征与土壤养分的研究[J]. 环境科学, 2015, 36(5): 1842-1848. Xiao Ye, Huang Zhigang, Wu Haitao, et al. Soil microorganism characteristics and soil nutrients of different wetlands in Sanjinag Plain, Northeast China[J]. Environmental Science, 2015, 36(5): 1842-1848. |
| [18] |
丁俊男, 于少鹏, 史传奇, 等. 寒区湿地不同土地利用方式对土壤理化性质和团聚体稳定性的影响[J]. 生态学杂志, 2021, 40(11): 3543-3551. Ding Junnan, Yu Shaopeng, Shi Chuanqi, et al. Effects of land use types on soil physicochemical properties and aggregates stability in cold region wetland[J]. Chinese Journal of Ecology, 2021, 40(11): 3543-3551. |
| [19] |
Yuan Haoshao, Ge Tida, Wu Xiaohong, et al. Long-term field fertilization alters the diversity of autotrophic bacteria based on the ribulose-1, 5-biphosphate carboxy-lase/oxygenase(RubisCO)large-subunit genes in paddy soil[J]. Applied Microbiology and Biotechnology, 2012, 95: 1061-1071. DOI:10.1007/s00253-011-3760-y |
| [20] |
Spain A M, Krumholz L R, Elshahed M S. Abundance, composition, diversity and novelty of soil Proteobacteria[J]. The ISME Journal, 2009, 3(8): 992-1000. DOI:10.1038/ismej.2009.43 |
| [21] |
章妮, 陈克龙, 王欣烨, 等. 青海湖沼泽湿地cbbM固碳微生物群落对模拟增温的动态响应[J]. 草地学报, 2024, 32(12): 3752-3763. Zhang Ni, Chen Kelong, Wang Xinye, et al. Dynamic response of the CBBM carbon-fixing microbial community to simulated warming in Qinghai Lake marsh wetland[J]. Acta Prataculturae Sinica, 2024, 32(12): 3752-3763. |
| [22] |
Ma Shengchao, Fang Jiaohui, Liu Jian, et al. Differences in sediment carbon-fixation rate and associated bacterial communities in four wetland types in Hulun Lake Basin[J]. Catena, 2022, 213: 106167. DOI:10.1016/j.catena.2022.106167 |
| [23] |
张勇, 丛军, 陆海, 等. 土壤酸杆菌群落结构与海拔多样性格局[J]. 环境科学杂志, 2014, 26(8): 1717-1724. Zhang Y, Cong J, Lu H, et al. Community structure and elevational diversity patterns of soil Acidobacteria[J]. Journal of Environmental Sciences, 2014, 26(8): 1717-1724. |
| [24] |
Gao X, Dong S, Xu Y, et al. Revegetation significantly increased the bacterial-fungal interactions in different successional stages of alpine grasslands on the Qinghai-Tibetan Plateau[J]. Catena, 2021, 205: 105385. DOI:10.1016/j.catena.2021.105385 |
| [25] |
Álvarez J A, Bécares E. The effect of plant harvesting on the performance of a free water surface constructed wetland[J]. Environmental Engineering Science, 2008, 25(8): 1115-1122. DOI:10.1089/ees.2007.0080 |
| [26] |
Yang Chao, Lv Dantong, Jiang Shenyi, et al. Soil salinity regulation of soil microbial carbon metabolic function in the Yellow River Delta, China[J]. Science of the Total Environment, 2021, 790: 148258. DOI:10.1016/j.scitotenv.2021.148258 |
| [27] |
李子旭, 李建华, 张强, 等. 不同复垦措施下土壤微生物群落的响应及组装过程[J]. 环境科学, 2024, 45(12): 7326-7336. Li Zixu, Li Jianhua, Zhang Qiang, et al. Response and assembly process of soil microbial communities under different reclamation measures[J]. Environmental Science, 2024, 45(12): 7326-7336. |
| [28] |
Campbell B J, Stein J L, Cary S C. Evidence of chemolithoautotrophy in the bacterial community associated with Alvinella pompejana, a hydrothermal vent polychaete[J]. Applied and Environmental Microbiology, 2003, 69(9): 5070-5078. DOI:10.1128/AEM.69.9.5070-5078.2003 |
| [29] |
Paula F S, Rodrigues J L M, Zhou Jizhong, et al. Land use change alters functional gene diversity, composition and abundance in Amazon forest soil microbial communities[J]. Molecular Ecology, 2014, 23(12): 2988-2999. DOI:10.1111/mec.12786 |
| [30] |
赵姣, 马静, 朱燕峰, 等. 植被类型对黄土高原露采矿山复垦土壤碳循环功能基因的影响[J]. 环境科学, 2023, 44(6): 3386-3395. Zhao Jiao, Ma Jing, Zhu Yanfeng, et al. Effects of vegetation types on carbon cycle functional genes in reclaimed soil from open pit mines in the Loess Plateau[J]. Environmental Science, 2023, 44(6): 3386-3395. |
 2025, Vol. 45
2025, Vol. 45 

