2. 河北省湿地近自然修复技术重点实验室, 河北大学, 河北 保定 071002;
3. 中国南水北调集团东线有限公司, 北京 100070
2. Hebei Provincial Key Laboratory of Wetland Near-nature Restoration Technology, Hebei University, Baoding, Hebei 071002, China;
3. China South-to-North Water Diversion Eastern Route Co., Ltd., Beijing 100070, China
土壤可利用碳源是影响土壤养分和土壤微生物自身元素平衡的重要物质[1],土壤环境变化会驱动碳含量和微生物群落发生改变。利用人工干预技术改善土壤微环境,以营养基质为载体改良土壤物质组成是卓有成效的手段。其中,添加碳源可以起到激活根际土壤微生物活性、改善土壤生态环境的作用。堆肥和生物炭作为外源碳改良土壤环境,可实现生物资源有效、可循环利用[2]。白洋淀流域芦苇遍布,近年来年均采收的芦苇地表以上植株部分重量可达1.28×105 t[3],芦苇秸秆利用不充分会造成严重的资源浪费,其腐烂丢弃或作为燃料,会对水环境和大气环境造成污染。芦苇经堆肥化处理、制备生物炭,可作为芦苇基碳源输入土壤,会在一定程度上对土壤结构稳定性、养分有效性、土壤生物多样性等产生积极影响,进而对土壤退化起到缓冲与调节作用[4]。芦苇基外源碳添加到土壤后对土壤理化性质、有机碳含量及矿化的影响有待深入探究。
有机废弃物资源化和肥料化利用是土壤养分循环和有机物管理的关键步骤。已有研究表明向土壤中添加葡萄糖、蔗糖等简单碳源[5],或是凋落物、秸秆和有机肥等复杂碳源会促进土壤矿化[6];也有研究表明,秸秆等碳源会增加表层土壤有机碳含量[7]。同时,添加秸秆、生物质能促进土壤团聚体的形成,提高土壤团聚体稳定性,外源碳添加量也会影响土壤团聚体粒径分布和稳定性[8]。利用秸秆可制备出具有较高孔隙度、较大比表面积、高度芳香化且性质相对稳定的生物炭,将生物炭加入土壤后其表面的负电荷及盐基离子可以改善土壤的pH值和阳离子交换量(CEC)[9]。也有研究[10]表明,添加生物炭对水稳性大团聚体含量无显著影响,因此,关于外源碳施用对土壤团聚体稳定性的影响结果存在分歧。土壤酶在土壤中的催化反应中起到了至关重要的作用,生物炭对土壤酶活性的影响也不尽相同。Luo Ling等[11]发现施加生物炭可增强苯酚氧化酶和β-葡萄糖苷酶活性,但会降低土壤过氧化物酶、N-乙酰氨基葡萄糖苷酶和酸性磷酸酶活性。
堆肥作为外源碳逐渐被广泛应用于不同土壤中以提高土壤肥力、植物生长和作物产量。研究表明,施用有机肥会提高土壤中不同组分有机碳的含量,轻组有机碳、纤维素、水溶性有机碳含量随着培养时间增长而增加[12]。堆肥腐殖化过程复杂,导致腐殖质组分差异[13],从而影响土壤中有机碳转化。堆肥有机质的稳定性在一定程度上降低了土壤呼吸的激发效应[14]。采用生物炭、堆肥混合施用的方法,可以提高土壤养分含量,促进植物生长,改善沙质土壤保水性能[15]。已有研究[16]多集中于外源碳提高土壤水分有效性、改善通气条件、吸附有毒化合物、养分含量与淋失等方面,尚缺乏不同碳源对土壤有机碳稳定性和转化机制的系统研究和解释。因此,本研究选取芦苇秸秆、生物炭和堆肥作为外源碳进行土壤培养试验,分析外源碳对土壤理化性质和有机碳矿化的影响,探讨外源碳输入与土壤有机碳稳定性的关系。本次试验将系统研究:①不同芦苇基外源碳对土壤理化性质影响,探索外源碳改良土壤的可行性;②探究外源碳对土壤酶活性影响和相关因素;③分析不同外源碳对土壤有机碳矿化的影响及动力学过程。
1 材料与方法 1.1 芦苇基外源碳材料的制备(1) 芦苇秸秆及生物炭的制备。试验用芦苇的采集地点为白洋淀圈头乡(北纬38°51′45.23″,东经116°01′25.17″),采集时间为2021年6月,将收割的芦苇使用粉碎机粉碎成1—2 cm小段,一部分通过干燥、粉碎过2 mm筛处理,用于土壤培养试验。另一部分用于生物炭制备,将芦苇清洗烘干后,粉碎成末状,将芦苇粉末放入模具填平压实,置于管式炉中,通入氮气以排尽炉腔内的氧气;20 min后,将管式炉以10 ℃/min的速率从室温升至100 ℃,进行20 min预热,并使原料受热均匀,再以10 ℃/min升温至800 ℃,恒温热解2 h,最后冷却至室温,得到黑色立方体状的成型生物炭产品。将得到的生物炭进行粉碎,随后进行洗涤、干燥,过2 mm筛网的生物炭颗粒用于堆肥调理和后续的土壤培养试验。
(2) 芦苇好氧堆肥。好氧堆肥产品以芦苇秸秆作为主要原料,设置两个堆肥试验组,分别采用底泥、生物炭不同组合作为调理剂对堆肥过程进行调节,其中,堆肥T1采用生物炭作为调理剂,添加质量比例为1/36;堆肥T2采用底泥和生物炭按照1∶1添加作为调理剂,添加质量比例为2/37。堆肥材料配比详见表 1。
|
|
表 1 芦苇堆肥试验分组情况 Table 1 Grouping of reed composting test |
将采集的芦苇进行除尘、水洗后,利用粉碎机粉碎至长度约3~5 cm,再利用破壁机将芦苇秸秆进行一步粉碎至5~10 mm,按照不同调理剂分组进行试验材料的添加,将芦苇、作为氮源的干鸡粪以及不同类型调理剂充分混合搅拌,调节含水率至60%,pH值至7左右,碳氮比调至25左右进行为期48 d的好氧堆肥。堆肥试验装置为定制的塑料培养箱(长100 cm,宽50 cm,高60 cm),外部用泡沫板做保温层,在培养箱底部约6 cm处放置一尼龙网布包裹的篦子,篦子下方用支撑架作以支撑,培养箱底部上方2 cm处开一个直径为2 cm的通风孔,用一个塑料管将塑料桶与鼓风机相连,进行通风供氧或散热,培养箱上方覆盖带孔塑料薄膜,在有助于堆体保水保温的同时防止厌氧发酵。堆肥生物炭调理剂为上述制备得到的芦苇秸秆生物炭,干鸡粪购于南京易循环农业科技有限公司;底泥采集自白洋淀表层沉积物,底泥(含水率90%左右)添加量以干重计算。堆肥过程中温度最高值为54 ℃和51 ℃,堆肥末期堆肥维持在27~28 ℃,堆肥试验得到的堆肥产品T1和堆肥产品T2。堆肥产品经自然风干,过2 mm筛应用于土壤培养试验。芦苇外源碳材料理化性质详见表 2。
|
|
表 2 芦苇基外源碳制备原料及外源碳产品基本性质 Table 2 Test basic properties of preparation materials and reed-based exogenous carbon products |
土壤培养试验分别设置对照组(CK),以及添加4种不同类型的外源碳和3种不同的添加量(5%,10%,15%)[17-18]的12个试验组,外源碳与土壤混合均匀,每个试验组设计3个平行试验,具体试验组设置及外源碳添加量详见表 3。
|
|
表 3 土壤培养试验组设置 Table 3 Setting of soil cultivation experimental group |
试验用土壤采样地位于距白洋淀岸边30 m退耕土壤。采集土壤经自然风干、去除杂物和块状土壤后,过2 mm筛,并将处理后土壤充分混合,放置于室内塑料箱中作为预处理土壤样品备用。土壤培养试验装置为塑料培养箱(20 cm×50 cm×18 cm),土壤和外源碳材料混合均匀后添加蒸馏水至田间最大持水量,并置于室温下进行培养,试验周期为60 d,每2 d向土壤中添加蒸馏水保持土壤含水量为田间最大持水量的60%左右。试验初期(0 d)和末期(60 d)分别取样检测土壤中pH值、容重(SBD)、阳离子交换量(CEC)、总有机碳、全氮以及β-葡萄糖苷酶(GAA)、脱氢酶(LDH)等指标。试验用土壤的初始理化性质详见表 4。
|
|
表 4 试验土壤基本理化性质 Table 4 Basic physico-chemical properties of experimental soil |
土壤有机碳矿化试验,按照表 3各处理组将相同预处理土壤分别称取100 g土壤放入1 L烧瓶中,采用NaOH吸收法研究土壤有机碳矿化率。土壤在25±1 ℃恒温箱中培养,定期加纯水保持土壤湿度为田间持水量的60%。在第2,4,6,8,10,20,30,40,50和60 d分别测定土壤样品的CO2排放量。定期取出0.5 mol/L NaOH(10 ml)吸收液测定CO2排放,加入1 mol/L BaCl2以及酚酞指示剂,使用0.5 mol/L HCl滴定,记录HCl消耗的体积。CO2释放量(mg/g)计算公式为:
| $ \begin{aligned} \mathrm{CO}_2 \text { 释放量 }= & \frac{\left(V_0-V\right) \times c}{2} \times 44 \times \\ & \frac{12}{44} \times \frac{1}{m \times(1-a)} \end{aligned} $ | (1) |
式中:V0为滴定不含土壤的烧瓶中NaOH吸收瓶对应的空白对照所消耗的HCl体积(ml);V为各处理组样品所消耗的HCl体积(ml);c为HCl浓度(mol/L);m为干燥土壤的质量(kg);a为土壤湿度。
1.3 土壤理化性质测定土壤容重采用环刀法测定,其中土壤含水量采用烘干法于105 ℃下烘干8 h后进行测定。土壤pH值采用电位法(土水比为1∶2.5)测定,称取10 g烘干土样,加入25 ml已去除CO2的蒸馏水,搅拌均匀,静置30 min后用pH计测定。土壤CEC依照《阳离子交换量的测定—三氯化六氨合钴浸提—分光光度法(HJ 889—2017)》。土壤与Co(NH3)6Cl3溶液比为3.5∶50(g/ml),振荡1 h后用紫外分光光度计于475 nm测上清液吸光度计算得出CEC含量。采用重铬酸钾容量法(外加热法)测定土壤有机碳含量。土壤全氮采用凯氏定氮法测定。土壤β-葡萄糖苷酶活性采用荧光微型板酶检测技术测定,土壤脱氢酶活性采用TTC分光光度法进行测定[19]。
1.4 数据统计分析采用单因素方差分析(ANOVA)和差异显著性分析各处理土壤理化指标、酶活性、有机碳矿化等指标数据;对土壤酶活性和土壤理化指标进行Pearson相关性分析。使用SPSS 18.0版进行统计分析,Origin 2021和Excel 2021进行图表绘制。
2 结果与分析 2.1 芦苇基外源碳添加对土壤理化性质的影响 2.1.1 外源碳添加对土壤容重的影响外源碳自身孔隙结构较为丰富,会对土壤的持水性和团聚体的形成产生一定的影响。土壤孔隙结构较为丰富时,土壤的容重在1.4~1.7 g/cm3之间,在有机质含量较高时,可达到1.1~1.4 g/cm3。初始阶段对照组与试验组土壤容重在1.19~1.29 g/cm3之间变化。由图 1可以看出,外源碳输入土壤各试验组与对照组相比,土壤容重略高,其原因与外源碳粒径较小,能够占据土壤颗粒之间的空隙有关,进而降低土壤孔隙度[20]。培养试验末期各组土壤容重发生变化,对照组土壤随着浇水和沉降等作用,在培养60 d后土壤容重增加了1.8%;而试验组土壤容重却均呈现下降趋势,除5%秸秆和15%堆肥T2试验组外,其他试验组培养前后差异不显著。表明芦苇基外源碳的添加会影响土壤均匀性,土壤颗粒重新排列[21],并对土壤结构起到调节作用。
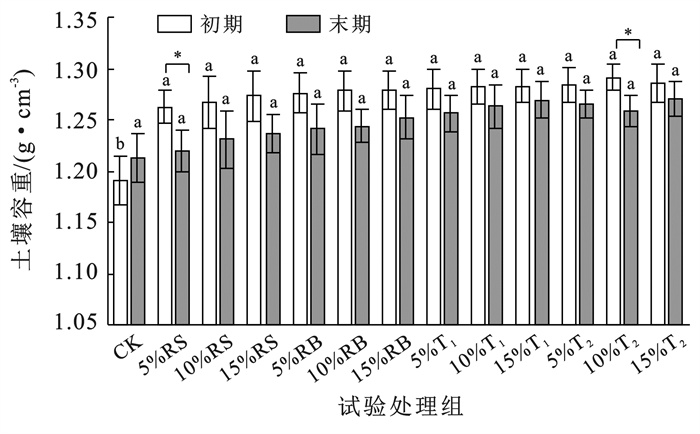
|
注:①CK为对照;RS为秸秆;RB为生物炭;T1和T2为不同成份的堆肥(成份详见表 1);②*表示相同处理培养初期和末期的差异显著(p<0.05);③不同小写字母表示各培养时期不同外源碳处理组间差异显著(p<0.05)。下同。 图 1 外源碳输入后土壤容重的变化 Figure 1 Changes in soil bulk density after exogenous carbon input |
土壤阳离子交换量是衡量土壤对无机养分元素保持能力的重要评价指标。由图 2可知,外源碳输入土壤培养过程中pH值、CEC发生明显变化。经60 d培养,除添加10%,15%秸秆和5%生物炭处理组外,各组土壤在培养期间pH值与CEC均呈现升高趋势,CEC增加在一定程度上提升了土壤保肥能力。除10%和15%芦苇秸秆组外,各试验组土壤呈碱性,对于土壤养分有效性、微生物摄取营养物质能起到一定促进作用。试验组土壤pH值,CEC高于对照组,且变化趋势一致。添加10%和15%秸秆处理组CEC减少,其中10%秸秆处理组在第60 d显著低于其他试验组(p<0.05)。堆肥试验组CEC在培养结束时较培养初期提高最为明显,其中,添加5%堆肥T2试验组的土壤CEC增加较为明显,增加了1.66 cmol/kg。
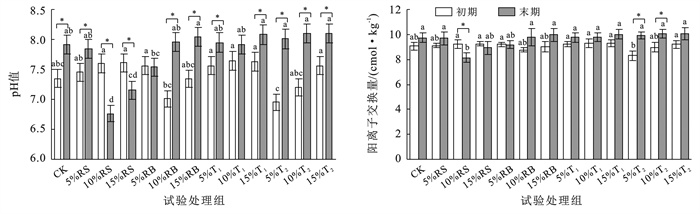
|
图 2 外源碳输入后土壤pH值、阳离子交换量(CEC)变化 Figure 2 Changes in soil pH value and cation exchange capacity after exogenous carbon input |
对比不同外源碳添加对土壤有机碳含量影响,如图 3所示,培养初期4种外源碳输入后土壤中有机碳含量得到明显增加,其中添加生物炭、堆肥的试验组土壤有碳含量为18.94~21.03 g/kg,显著提高了47.2%~64.2%(p<0.05)。培养末期,除对照组和添加5%秸秆试验组外,其他组土壤有机碳含量与培养初期相比均呈显著降低趋势(p<0.05),含量降低至14.83~18.65 g/kg,变化范围在12.5%~31.3%之间。对于添加堆肥试验组,添加量为5%,10%试验组较添加15%试验组的土壤有机碳降低趋势更显著,主要是由于堆肥中含有多种可被微生物直接利用的有效碳源,堆肥添加量的增加,通过影响土壤微生物群落组成和演替过程,间接影响有机碳转化[22]。
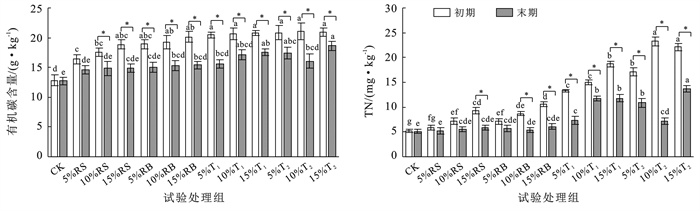
|
图 3 外源碳输入后土壤有机碳、全氮变化 Figure 3 Changes in soil organic carbon and total nitrogen after exogenous carbon input |
氮素是衡量土壤肥力的重要指标之一,同时也是作物生长的重要营养元素。由图 3可以看出,试验初期添加4种外源碳试验组土壤全氮含量提高了13%~348%,除5%秸秆组,其余各试验组土壤全氮含量均显著高于对照组(p<0.05),添加10%堆肥外源碳T2试验组培养初期土壤全氮含量最大。经过60 d培养,对照组、添加5%,10%秸秆和5%生物炭试验组的土壤全氮含量变化不显著,其他外源碳试验组土壤全氮呈现显著降低趋势,且不同种外源碳施加后土壤氮含量降低趋势由大到小依次为:堆肥T2>堆肥T1>生物炭>秸秆,其中添加堆肥T2试验组全氮含量降低程度最为显著,较培养初期降低了36.3%~69.1%。
2.2 外源碳添加对土壤酶活性的影响由图 4可知,外源碳添加提高了土壤β-葡萄糖苷酶(GAA)、脱氢酶(LHD)含量。相较对照组,外源碳试验组β-葡萄糖苷酶含量均有增加,堆肥T2组的初始β-葡萄糖苷酶含量最高,为0.93~0.96 μg/g;经60 d培养,土壤β-葡萄糖苷酶含量均显著增加,其中对照组酶含量增加了0.26 μg/g,秸秆试验组平均增加了0.27±0.03 μg/g,生物炭、堆肥试验组β-葡萄糖苷酶含量显著高于秸秆试验组和对照组,增加了0.28~0.31 μg/g。脱氢酶与β-葡萄糖苷酶的变化趋势基本一致,外源碳添加初始阶段显著提高了土壤脱氢酶含量(p<0.05),其中15%堆肥T2组脱氢酶含量最高为23.51±0.60 μg/g;培养末期,生物炭和堆肥试验组土壤脱氢酶活性显著增加(p<0.05),其中生物炭处理组增长了3.13±0.74 μg/g,堆肥T1,T2处理组平均增长了约4.40±0.17 μg/g,4.55±0.33 μg/g,对照组和秸秆试验组土壤脱氢酶也呈增加趋势但变化不显著。
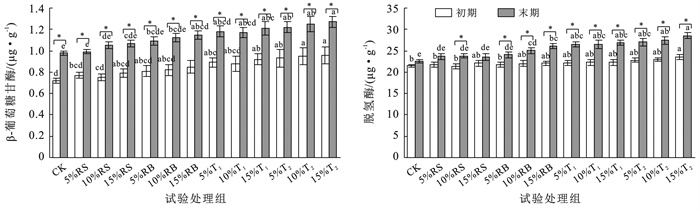
|
图 4 外源碳输入后土壤β-葡萄糖苷酶、脱氢酶含量变化 Figure 4 Changes in contents of beta-glucosidase and dehydrogenase in soil after exogenous carbon input |
外源碳添加量对酶活性影响结果表明酶活性的变化与外源碳添加量呈正相关关系(图 5),15%堆肥T2试验组β-葡萄糖苷酶和脱氢酶活性最高,平均值分别为1.27和28.51 μg/g,10%堆肥T1组β-葡萄糖苷酶出现显著下降。外源碳添加量为10%的各试验组中脱氢酶含量与15%的各试验组相比差距并不明显。各试验组酶活性均高于对照组β-葡萄糖苷酶0.98±0.02 μg/g,脱氢酶2.5±0.40 μg/g,表明芦苇基外源碳的添加有效地改善了土壤酶活性,一定程度上反映了微生物的代谢速率增强。
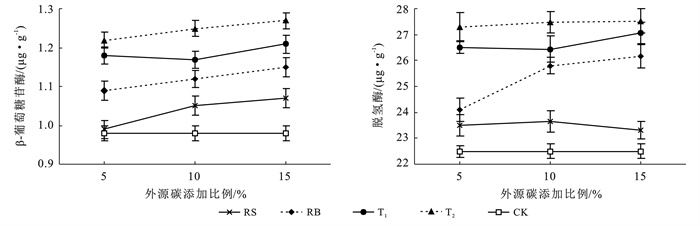
|
图 5 添加不同量外源碳后土壤β-葡萄糖苷酶、脱氢酶活性的变化 Figure 5 Changes in activities of beta-glucosidase and dehydrogenase in soil after adding different amounts exogenous carbon |
土壤酶活性与理化性质的Pearson相关性分析结果详见表 4。由表 4可知,β-葡萄糖苷酶与土壤中容重(0.97)、有机碳(0.88)、全氮(0.76)表现为极显著的正相关性(p<0.01)。脱氢酶同样与土壤容重、土壤有机碳、全氮表现为极显著的正相关性(p<0.01)。因此,芦苇基外源碳对土壤理化性质的改善作用,有利于土壤微生物活性,进而促进土壤活性物质土壤酶的含量。
|
|
表 4 土壤活性、理化指标Pearson相关性分析 Table 4 Pearson correlation analysis of soil enzyme activity and physicochemical indexes |
培养期间累积矿化量变化和各处理组60 d累积矿化量变化如图 6—7所示。有机碳累积矿化量为堆肥T1,生物炭,秸秆添加试验组显著高于堆肥T2添加试验组、对照组。通过对比4种外源碳试验组的碳累积矿化量曲线,在培养初始阶段,容易利用的有机化合物被分解利用,CO2释放速率较高,培养10 d后,以结构复杂的有机物组分分解为主,CO2释放速率减慢[23]。不同外源碳添加量对有机碳矿化效率的影响差异显著,其中秸秆和堆肥T1添加量与土壤有机碳矿化量呈正相关,添加量15%试验组土壤有机碳矿化量为721.4~758.2 mg/kg,显著高于添加量5%试验组652.9~700.9 mg/kg,添加比例的增加导致土壤有机碳矿化量增加这一结果与前人[24]研究一致,即外源碳添加量增加影响了微生物群落组成和有机碳分解代谢速率,进而促进土壤有机碳的转化效率。
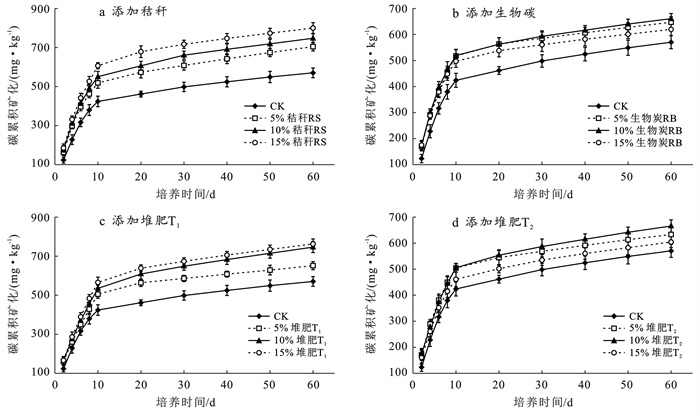
|
图 6 土壤培养期间不同外源碳处理组土壤有机碳累积矿化量变化 Figure 6 Changes in cumulative mineralization amount of soil organic carbon in different exogenous carbon treatment groups during soil incubation |

|
图 7 不同外源碳添加60 d时的累积矿化量变化 Figure 7 Cumulative mineralization amount at 60 days after adding different exogenous carbons |
在60 d培养试验期间土壤有机碳累积矿化均符合一级动力学模型(R2=0.97~0.99,p<0.05)(表 5)。根据公式计算的潜在有机碳矿化量(C0),不同外源碳添加处理对C0有显著影响(p<0.05)。培养期间,对照组土壤有机碳矿化率最低,堆肥T2试验组在培养60 d时,添加量为5%,10%和15%试验组的潜在有机碳矿化量分别为598.3,623.7和565.0 mg/kg,显著低于秸秆和生物炭试验组土壤潜在有机碳矿化量(652.9~758.2 mg/kg)。随着秸秆添加量的增加,CO2释放量的增加可能是由于秸秆有机碳相对容易分解,C0也随之增加;随着生物炭添加量增加,C0显著降低,主要由于生物炭中含有一定量的顽固性芳香型碳,不易被微生物分解,此外,添加生物炭试验组的碳累积矿化量低于秸秆和堆肥T1试验组,这可能是由于生物炭处理中微生物可利用和矿化碳量明显低于秸秆和堆肥[25]。
|
|
表 5 不同外源碳添加土壤有机碳矿化一级动力学方程拟合参数 Table 5 First order kinetic equation fitting parameters of soil organic carbon mineralization with different exogenous carbon |
(1) 芦苇基外源碳对土壤理化性质具有调控和改良作用。外源碳添加土壤容重没有表现出显著影响,这与土壤矿物组成的稳定性有关,少量外源碳的添加改变土壤有机碳等组分,但对土壤容重影响效果有限,此外,外源碳的施加时间也可能对土壤的微环境产生显著的影响[25]。外源碳添加组土壤pH与CEC均有所增加,由于外源碳携带的Ca2+,K+,Mg2+等离子释放到土壤,或与土壤胶体表面Al3+和H+发生离子交换作用,降低土壤pH值并增加土壤保肥性,已有研究表明,添加生物质炭可提高土壤CEC,且与添加量成正比[26];堆肥外源碳有机质组分含量较高,大量两性有机官能团可显著提升阳离子交换能力,因此堆肥产品对土壤酸碱缓冲性能、离子交换及有机质含量等方面具有改良作用[15]。另外,土壤中可利用碳源数量制约微生物对氮的利用,微生物通过利用土壤中营养元素维持自身碳氮平衡,培养试验初期4种外源碳的添加在一定程度上促进了土壤中全氮含量的增加,这归因于外源碳自身较高含氮量(表 2),以及外源碳添加为氮元素循环细菌提供了充足的碳源[27],这与巨晓棠等[28]发现添加高碳氮比外加碳源能够显著提高土壤有机碳氮库的结论一致。堆肥添加试验组土壤全氮增加量显著高于生物炭、秸秆试验组,主要是堆肥过程中蛋白质等大分子有机物被发酵过程中优势菌种分解成更易被微生物吸收利用的小分子组分,堆肥中活跃组分和微生物更具多样性。随着堆肥添加量提高到15%,全氮的下降趋势反而减弱,主要是由于微生物会优先利用小分子有机物,充足的有效碳源促进了微生物对氮素的固持[29]。
(2) 土壤酶与外源碳添加土壤理化性质显著相关。当土壤pH值、有机碳含量发生变化时,酶的活性也会发生改变,β-葡萄糖苷酶在微生物有机质代谢过程发挥重要作用,试验采用的芦苇外源碳中含有大量的木质纤维素,外源碳输入土壤后为微生物提供维持生命活动的碳源。脱氢酶能够催化大分子有机物氧化还原,在一定程度上反映微生物活性,堆肥外源碳对土壤中脱氢酶活性影响显著高于生物炭、秸秆试验组和对照组,主要由于堆肥成分复杂和高生物活性,能够通过调节土壤微生物生长环境和所需养分,在调节土壤微生物群落结构方面起到了至关重要的作用[22]。已有研究[30]表明在营养物质充足的条件下,土壤含水率、土壤pH值等理化性质将成为土壤酶活性限制因素,因此本研究外源碳10%和15%添加量下土壤脱氢酶活性差异不显著,外源碳添加量对土壤微环境改善作用有限。外源碳输入土壤增强β-葡萄糖苷酶、脱氢酶活性,促进土壤中物质循环过程,有研究发现生物炭、堆肥能够提升酶的活性[31],碳氮比与酶活性呈正相关性,这与本研究酶活性变化趋势相印证。
(3) 土壤有机碳矿化与外源碳种类和添加量具有相关性。已有研究[32]表明外源碳种类和添加量对土壤微生物丰度、群落结构的影响具有不同规律,作为外源碳输入对土壤有机碳总量的贡献,堆肥通常通过提供可利用的底物积极影响微生物活动,进而影响土壤有机碳矿化。本研究中,芦苇秸秆作为外源碳在一定程度上促进了土壤有机碳转化,对土壤有机碳矿化起到了激发效应[33],由于秸秆通常含有新鲜的植物生物质碳(多糖等),微生物对土壤—秸秆混合物中有机物易分解组分具有较强矿化作用,可一定程度上增强微生物活性[34];但芦苇秸秆木质纤维素组结构稳定,微生物降解速率缓慢,因此在短时间内无法证明长周期培养条件下秸秆对土壤有机碳矿化产生激发或负激发效果,也有研究表明长时间秸秆还田能够改变土壤碳组分转化[6]。生物炭试验组土壤有机碳矿化量低于秸秆组,这与生物炭具有一定吸附作用,对释放的CO2等气体具有一定吸收效果有关[21]。芦苇堆肥作为外源碳对有机碳矿化存在一定程度的负激发效应[35],由于堆肥本质上是微生物分解有机质在经过腐殖化过程后形成大分子有机物,堆肥中大分子有机物矿化为无机碳的速率相对较慢,因此在试验周期内具有一定的负激发效果,对土壤碳固存起到了一定的改善作用。本研究中15%堆肥试验组,60 d培养后有机碳含量将低于添加量10%试验组,这主要与堆肥中腐殖质碳结构复杂,微生物对腐殖质碳分解速率慢有关[36]。外源碳的输入固然为微生物提供更加充足的碳源,但输入外源碳是否为有效碳源对于土壤矿化速率及土壤碳固存也尤为重要。
4 结论(1) 芦苇基外源碳输入后土壤理化性质得到显著改善,其中土壤pH值和CEC明显增加,且两者变化趋势具有极强的相关性,生物炭和堆肥对土壤酸碱缓冲性及保肥性改良作用显著优于秸秆外源碳;同时,添加外源碳试验组土壤有机碳、全氮含量显著降低,在一定程度上促进了土壤有机碳和全氮矿化。
(2) 芦苇基外源碳输入后显著提高了土壤β-葡萄糖苷酶和脱氢酶活性,其中生物炭和堆肥影响最为显著;土壤酶活性与土壤容重、总有机碳、全氮含量变化表现为现极强的相关性,外源碳添加量并非影响土壤酶活性的提高效果的主要因素。
(3) 芦苇秸秆对土壤有机碳矿化的激发效应最显著,堆肥对土壤有机碳矿化均存在一定程度的抑制效果,从而对土壤碳库组成和固碳能力起到优化调控作用。
| [1] |
Liu Dong, Keiblinger K M, Schindlbacher A, et al. Microbial functionality as affected by experimental warming of a temperate mountain forest soil: A metaproteomics survey[J]. Applied Soil Ecology, 2017, 117: 196-202. |
| [2] |
Tsouko E, Kachrimanidou V, dos Santos A F, et al. Valorization of by-products from palm oil mills for the production of generic fermentation media for microbial oil synthesis[J]. Applied Biochemistry and Biotechnology, 2017, 181(4): 1241-1256. DOI:10.1007/s12010-016-2281-7 |
| [3] |
崔俊辉, 董鑫. 白洋淀芦苇生态功能与经济发展研究[J]. 石家庄铁道大学学报(社会科学版), 2020, 14(3): 34-38. Cui Junhui, Dong Xin. Analysis of the eco-function and economic development of reeds in Xiong'an new district[J]. Journal of Shijiazhuang Tiedao University (Social Science Edition), 2020, 14(3): 34-38. |
| [4] |
Gosain B, Gcs N, Dhyani P P, et al. Ecosystem services of forests: Carbon stock in vegetation and soil components in a watershed of Kumaun Himalaya, India[J]. International Journal of Ecology and Environmental Sciences, 2015, 41(3/4): 177-188. |
| [5] |
Nottingham A T, Whitaker J, Ostle N J, et al. Microbial responses to warming enhance soil carbon loss following translocation across a tropical forest elevation gradient[J]. Ecology Letters, 2019, 22(11): 1889-1899. DOI:10.1111/ele.13379 |
| [6] |
李小刚, 崔志军, 王玲英. 施用秸秆对土壤有机碳组成和结构稳定性的影响[J]. 土壤学报, 2002, 39(3): 421-428. Li Xiaogang, Cui Zhijun, Wang Lingying. Effect of straw on soil organic carbon constitution and structural stability[J]. Acta Pedologica Sinica, 2002, 39(3): 421-428. DOI:10.3321/j.issn:0564-3929.2002.03.018 |
| [7] |
安婉丽, 高灯州, 潘婷, 等. 水稻秸秆还田对福州平原稻田土壤水稳性团聚体分布及稳定性影响[J]. 环境科学学报, 2016, 36(5): 1833-1840. An Wanli, Gao Dengzhou, Pan Ting, et al. Effect of rice straw returning on paddy soil water-stable aggregate distribution and stability in the paddy field of Fuzhou plain[J]. Acta Scientiae Circumstantiae, 2016, 36(5): 1833-1840. |
| [8] |
Moreno-Barriga F, Díaz V, Acosta J A, et al. Organic matter dynamics, soil aggregation and microbial biomass and activity in Technosols created with metalliferous mine residues, biochar and marble waste[J]. Geoderma, 2017, 301: 19-29. DOI:10.1016/j.geoderma.2017.04.017 |
| [9] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota: A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [10] |
Grunwald D, Kaiser M, Ludwig B. Effect of biochar and organic fertilizers on C mineralization and macro-aggregate dynamics under different incubation temperatures[J]. Soil and Tillage Research, 2016, 164: 11-17. DOI:10.1016/j.still.2016.01.002 |
| [11] |
Luo Ling, Wang Guolan, Shi Guozhong, et al. The characterization of biochars derived from rice straw and swine manure, and their potential and risk in N and P removal from water[J]. Journal of Environmental Management, 2019, 245: 1-7. |
| [12] |
邵慧芸, 李紫玥, 刘丹, 等. 有机肥施用量对土壤有机碳组分和团聚体稳定性的影响[J]. 环境科学, 2019, 40(10): 4691-4699. Shao Huiyun, Li Ziyue, Liu Dan, et al. Effects of manure application rates on the soil carbon fractions and aggregate stability[J]. Environmental Science, 2019, 40(10): 4691-4699. |
| [13] |
李孟婵, 张鹤, 杨慧珍, 等. 不同原料好氧堆肥过程中碳转化特征及腐殖质组分的变化[J]. 干旱地区农业研究, 2019, 37(2): 81-87. Li Mengchan, Zhang He, Yang Huizhen, et al. Effects of different compost materials on carbon transformationand the change of humus during composting process[J]. Agricultural Research in the Arid Areas, 2019, 37(2): 81-87. |
| [14] |
Teutscherova N, Vazquez E, Santana D, et al. Influence of pruning waste compost maturity and biochar on carbon dynamics in acid soil: Incubation study[J]. European Journal of Soil Biology, 2017, 78: 66-74. |
| [15] |
Safaei Khorram M, Zhang Gan, Fatemi A, et al. Impact of biochar and compost amendment on soil quality, growth and yield of a replanted apple orchard in a 4-year field study[J]. Journal of the Science of Food and Agriculture, 2019, 99(4): 1862-1869. |
| [16] |
Oldfield T L, Sikirica N, Mondini C, et al. Biochar, compost and biochar-compost blend as options to recover nutrients and sequester carbon[J]. Journal of Environmental Management, 2018, 218: 465-476. |
| [17] |
郎立娜, 孙正骁, 陈元晖, 等. 蚯蚓和细菌对秸秆混粪改良苏打盐碱土碳转化及微生物群落的影响[J]. 农业资源与环境学报, 2023, 40(2): 412-422. Lang Lina, Sun Zhengxiao, Chen Yuanhui, et al. Effects of earthworms and bacteria on carbon transformation and microbial community of soda saline-alkali soil by improvements of straw and manure mixture[J]. Journal of Agricultural Resources and Environment, 2023, 40(2): 412-422. |
| [18] |
王淑琦. 添加纤维素酶对绿化废弃物堆肥腐熟的影响研究[D]. 北京: 北京林业大学, 2017. Wang Shuqi, Effects of adding cellulase on maturity of greening waste composting[D]. Beijing: Beijing Forestry University, 2017. |
| [19] |
荣勤雷, 梁国庆, 周卫, 等. 不同有机肥对黄泥田土壤培肥效果及土壤酶活性的影响[J]. 植物营养与肥料学报, 2014, 20(5): 1168-1177. Rong Qinlei, Liang Guoqing, Zhou Wei, et al. Effects of different organic fertilization on fertility and enzyme activities of yellow clayey soil[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(5): 1168-1177. |
| [20] |
Zhang Shaobo, Fang Yunying, Luo Yu, et al. Linking soil carbon availability, microbial community composition and enzyme activities to organic carbon mineralization of a bamboo forest soil amended with pyrogenic and fresh organic matter[J]. Science of the Total Environment, 2021, 801: 149717. |
| [21] |
Khaledi S, Delbari M, Galavi H, et al. Effects of biochar particle size, biochar application rate, and moisture content on thermal properties of an unsaturated sandy loam soil[J]. Soil and Tillage Research, 2023, 226: 105579. |
| [22] |
Mohan D, Preetiva B, Chaubey A K, et al. Eggplant growth in wheat straw, wheat straw biochar-and compost-amended soils: A field study of CO2 emission dynamics, soil physicochemical, microbial, and nutrient effects[J]. Waste Management Bulletin, 2024, 1(4): 143-157. |
| [23] |
Rogovska N, Laird D, Cruse R, et al. Impact of biochar on manure carbon stabilization and greenhouse gas emissions[J]. Soil Science Society of America Journal, 2011, 75(3): 871-879. |
| [24] |
Rodríguez-Vila A, Asensio V, Forján R, et al. Carbon fractionation in a mine soil amended with compost and biochar and vegetated with Brassica juncea L[J]. Journal of Geochemical Exploration, 2016, 169: 137-143. |
| [25] |
Nanda S, Dalai A K, Berruti F, et al. Biochar as an exceptional bioresource for energy, agronomy, carbon sequestration, activated carbon and specialty materials[J]. Waste and Biomass Valorization, 2016, 7(2): 201-235. |
| [26] |
葛顺峰, 彭玲, 任饴华, 等. 秸秆和生物质炭对苹果园土壤容重、阳离子交换量和氮素利用的影响[J]. 中国农业科学, 2014, 47(2): 366-373. Ge Shunfeng, Peng Ling, Ren Yihua, et al. Effect of straw and biochar on soil bulk density, cation exchange capacity and nitrogen absorption in apple orchard soil[J]. Scientia Agricultura Sinica, 2014, 47(2): 366-373. |
| [27] |
姬强. 不同耕作措施和外源碳输入对土壤结构和有机碳库的影响[D]. 陕西杨凌: 西北农林科技大学, 2016. Ji Qiang. Soil structure and organic carbon response to tillage practices and exogenous carbon application[D]. Yangling, Shaanxi: Northwest Agriculture & Forestry University, 2016. |
| [28] |
巨晓棠, 谷保静. 我国农田氮肥施用现状、问题及趋势[J]. 植物营养与肥料学报, 2014, 20(4): 783-795. Ju Xiaotang, Gu Baojing. Status-quo, problem and trend of nitrogen fertilization in China[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 783-795. |
| [29] |
张乐. 不同C源对外源N土壤微生物固持的影响[D]. 新疆乌鲁木齐: 新疆农业大学, 2008. Zhang Le. The effect of different C source on microbe immobilization by supplemental N[D]. Urumqi, Xinjiang: Xinjiang Agricultural University, 2008. |
| [30] |
徐国伟, 段骅, 王志琴, 等. 麦秸还田对土壤理化性质及酶活性的影响[J]. 中国农业科学, 2009, 42(3): 934-942. Xu Guowei, Duan Hua, Wang Zhiqin, et al. Effect of wheat-residue application on physical and chemical characters and enzymatic activities in soil[J]. Scientia Agricultura Sinica, 2009, 42(3): 934-942. |
| [31] |
冯慧琳, 徐辰生, 何欢辉, 等. 生物炭对土壤酶活和细菌群落的影响及其作用机制[J]. 环境科学, 2021, 42(1): 422-432. Feng Huilin, Xu Chensheng, He Huanhui, et al. Effect of biochar on soil enzyme activity & the bacterial community and its mechanism[J]. Environmental Science, 2021, 42(1): 422-432. |
| [32] |
Cooper A, DeMarco J. Composted biosolids amendments for enhanced soil organic carbon and water storage in perennial pastures in Colorado[J]. Agriculture, Ecosystems & Environment, 2023, 347: 108401. |
| [33] |
魏圆云, 崔丽娟, 张曼胤, 等. 土壤有机碳矿化激发效应的微生物机制研究进展[J]. 生态学杂志, 2019, 38(4): 1202-1211. Wei Yuanyun, Cui Lijuan, Zhang Manyin, et al. Research advances in microbial mechanisms underlying priming effect of soil organic carbon mineralization[J]. Chinese Journal of Ecology, 2019, 38(4): 1202-1211. |
| [34] |
Ayuke F O, Brussaard L, Vanlauwe B, et al. Soil fertility management: Impacts on soil macrofauna, soil aggregation and soil organic matter allocation[J]. Applied Soil Ecology, 2011, 48(1): 53-62. |
| [35] |
安丽芸. 微生物多样性及外加碳源对土壤碳矿化的影响[D]. 山西太原: 山西大学, 2018. An Liyun. The effect of microbial diversity and carbon sources on soil mineralization[D]. Taiyuan, Shanxi: Shanxi University, 2018. |
| [36] |
Jain M S, Kalamdhad A S. Soil revitalization via waste utilization: Compost effects on soil organic properties, nutritional, sorption and physical properties[J]. Environmental Technology & Innovation, 2020, 18: 100668. |
 2024, Vol. 44
2024, Vol. 44 

