2. 水利水资源安徽省重点实验室, 安徽 蚌埠 233000
2. Anhui Province Key Laboratory of Water Conservancy and Water Resources, Bengbu, Anhui 233000, China
农业面源污染是水体富营养化的主要原因,其贡献率大大超过城市、工业的点源污染。农村生活污水排放量较少且时间集中,日变化系数大[1]。水生植物修复技术因其环境友好、成本低、净化能力突出等特点,逐渐成为一种重要的生态治理方法[2-3]。水生植物除本身能吸收同化氮磷等污染物外,还能通过根系沁氧[4]、细胞释放无机离子、糖类和有机酸等方式,为微生物提供生长代谢所需碳源。
据调查统计,中国水生植物共有61科,168属,741种[5],用于湿地、河道修复等生态处理的研究多数集中在芦苇、菖蒲以及苦草、金鱼藻等常见的单一生态型[6-7],这一类存在易受季节影响以及抗逆性差等问题,合理的植物群落组合的净化效果更稳定[8]。李欢等[9]认为混合群落中植被相对生长速率和累积生物量显著高于单独种植时期,Rodriguez等[10]发现芦苇与虉草的组合可以维持高效去污和低硝酸盐浓度之间的稳定关系。另一方面,不同的植物组合和种植条件构建的湿地系统其脱氮除磷特征也存在差异。周玥等[11]发现高浓度污水中单种挺水植物对TP的净化效果较好而多种植物组合对TN的净化效果更好。一般来说,湿地系统对污水中氮、磷的去除率平均能达到60%~90%[12],但植物吸收对氮、磷去除贡献率平均只在6%~20%之间[13],氮、磷物质的吸收同化是植物修复的主要去除方式[14]。相当部分的氮磷养分以沉积的方式被底泥截留,沉积物蓄积是氮、磷最主要的支出途径,占总支出氮、磷的比例为28.6%和42.3%[15]。关于适宜区域环境和不同生态型湿地植物组合的净化效果仍有待深入研究,同时有关湿地系统内氮磷养分去向特征的研究少有报道。因此,深入探讨氮磷高效吸收的最优植物组合模式对提高乡村生态综合治理效益具有重要的现实意义和工程价值。
本文选取不同生态型的6种湿地植物,在室内静水条件下通过植物生物量、污水氮、磷去除率、植物和底泥吸附量等多方面研究其镶嵌组合对污水的净化效果,分析污染物去除特征和途径,旨在优化水生植物配置,为构建湿地植物和乡村生态综合治理模式提供理论依据。
1 材料与方法 1.1 试验材料所用水生植物来自安徽省蚌埠市新马桥试验站沟塘内种植并自然生长较好的植株,包括苦草、菖蒲、梭鱼草、再力花、美人蕉、鸢尾共6种挺水和沉水植物,均属于中—富营养生境营养特征。种植水箱为方形聚乙烯塑料材质,长510 mm,宽380 mm,高790 mm,白色半透明避光。水箱铺设底泥采自植株预培养时大沟内的污泥,沙姜黑土,土壤容重约1.48 g/cm3。距桶底300 mm处的设出水龙头,用于排水和采集水样。受试水体来源于试验站内集中式生活污水化粪池,其污水来源主要为厨房炊事、沐浴洗涤和厕所排水,与周边农村生活污水特征相近,主要污染指标浓度范围:NH4+-N在5~20 mg/L之间,TN在15~50 mg/L之间,TP在2~10 mg/L之间。
1.2 试验设计将所选取的各类植株,按照生长习性和景观效益进行组合配置,依次为:单一挺水种植组的再力花(Z)、美人蕉(M)、菖蒲(C)、梭鱼草(S)、鸢尾(Y),单一沉水种植组的苦草(K),组合种植组的苦草+再力花(K+Z)、苦草+美人蕉(K+M)、苦草+菖蒲(K+C)、苦草+梭鱼草(K+S)、苦草+鸢尾(K+Y)。各组试验水箱内种植密度保持一致,同时以无植物种植的水箱作为空白试验组。试验共12组处理,每组3个重复。
试验于2020年7月2日至9月2日开展,共计63 d,在自然通风条件下进行,场地设有挡雨棚,雨天时打开避雨。先采集底泥,待搅拌、混合均匀后覆于箱底,每桶底泥厚度为200 mm。再挑选沟塘内预培养的各类长势良好,大小一致的植株冲洗干净后移至箱内,加入同位置水样直至高出底泥基质200 mm处,再培育6~7 d左右。待植物长势稳定后排净培养水,最后每桶加入40 L试验站内化粪池中的生活污水。期间定期(5~7 d)补加少量蒸馏水至初始高度,以维持水位。
1.3 采样与测试(1) 水样。自试验开始时每7d采集1次水样,分两部分完成测试,一部分不过滤用全自动化学分析仪(Smartchem_200)测试总氮(TN)—过硫酸钾分光光度法、总磷(TP)—过硫酸钾氧化—钼蓝比色法,另一部分经0.45μm的滤纸过滤测氨态氮(NH4+-N)—纳氏试剂比色法。
(2) 底泥样品。试验开始时于每个水箱内的底泥表层5 cm深度处,沿对角线等距离取土,采集10 g底泥样品作为本底值;另在试验中期(7月29日)和试验结束时(9月2日)分别采集各箱内的底泥。样品分为2份:一份鲜样用自封袋保存在4 ℃冰箱中,用于测定底泥pH值,NH4+-N含量等;另一部分经自然风干研磨成粉末,过100目筛用于测定TN,TP含量。NH4+-N含量采用氯化钾浸提—流动注射仪法测定;TN含量经H2SO4消解后,用半微量凯氏定氮法测定;采用硫酸—高氯酸消煮—钼锑抗比色法,用全自动化学分析仪测定TP含量。
(3) 植物样品。试验开始时,取大小、长势较为接近的样品,测定初始生物量及各项指标;试验结束时每组收获大小、长势较为平均的整株植物,测定其生长量及各项指标。采集后的植株样品依次用自来水、去离子水冲洗干净,滤纸吸干水分,分根、茎叶称鲜重,之后放置在85 ℃烘箱内烘干至恒重,测量植株干重。经粉碎研细后用过0.15 mm筛,采用半微量开氏方法,用凯氏定氮仪测定植株TN含量;采用硫酸—高氯酸消煮—钼锑抗比色法,用全自动化学分析仪测定植株TP含量。
1.4 数据分析植物相对生长速率的计算公式[16]如下:
| $ {\rm{RGR}} = {\rm{ln}}({B_t}/{B_{\rm{0}}})/t $ | (1) |
式中:RGR为植物的相对生长速率(%/d);B0和Bt分别为实验开始和结束时植物的总生物量(g);t为实验周期(d),本研究中t为60 d。
单位面积植物平均氮(磷)吸收量计算公式为:
| $ {Q_p} = {P_{{C_i}}} \times {P_{{B_i}}} $ | (2) |
式中:Qp为单位面积植物平均氮(磷)吸收量〔mg/(m2·d)〕;PBi为试验开始时、结束时单位面积植物干重(g/m2);PCi为试验开始时、结束时植株内氮(磷)含量(mg/g)。
单位面积底泥平均氮(磷)吸收量计算公式为:
| $ {Q_s} = 1{\rm{ }}000 \times {\rho _b} \times V \times \left( {{C_{{S_t}}} - {C_{{S_0}}}} \right)/S $ | (3) |
式中:Qs为单位面积底泥平均氮(磷)吸收量〔mg/(m2·d)〕;ρb为底泥容重(g/cm3); V为水箱内底泥体积(m3);CSt为第t天时底泥氮(磷)含量(mg/g);CS0为试验开始时底泥氮(磷)背景含量(mg/g);S为有效面积(m2)。
采用Microsoft Excel计算数据、绘图,采用统计分析软件SPSS22.0进行数据分析。
2 结果与分析 2.1 污染物去除效果包括空白对照组在内,各试验水箱内水体中TN,NH4+-N,TP浓度随着时间变化均呈现逐渐降低的趋势。第8 d各组TN,NH4+-N浓度即有显著降低的表现,并在36 d达到最低值,平均为1.19,0.54 mg/L,好于Ⅱ类地表水质标准,说明植物对水体中氮素的吸收反应十分迅速,由于试验开展在夏季,环境及水体温度较高有利于水体中氮素的挥发。43 d时各组水体TP浓度变化趋于平缓,单一种植组略高,平均在0.34 mg/L,而组合种植组TP浓度平均仅0.15 mg/L。水体中TN,NH4+-N,TP平均去除率分别达到96.6%, 93.2%和95.9%,显著高于对照组。单一植物中再力花的TN去除率最高,美人蕉最低;鸢尾组、苦草+鸢尾组对TP去除率最高,苦草+梭鱼草组最低。苦草在种植培养前后长势虽变化不大,但其对TN, TP的去除效果依然较好;整体上单一种植组中TN, NH4+-N去除效果与混合种植组并无显著差异,混合种植组对TP去除率略高于单一种植组(图 1)。
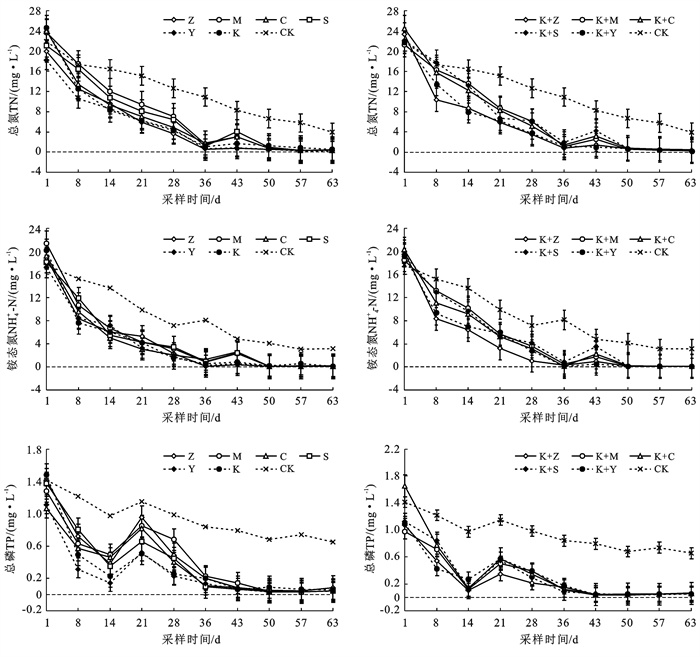
|
注:Z,M,C,S,Y分别为单一挺水种植组的再力花、美人蕉、菖蒲、梭鱼草、鸢尾,K为单一沉水种植组的苦草,(K+Z),(K+M),(K+C),(K+S),(K+Y)分别为组合种植组的苦草+再力花、苦草+美人蕉、苦草+菖蒲、苦草+梭鱼草、苦草+鸢尾。下同。 图 1 不同处理组TN,NH4+-N,TP浓度变化 |
如表 1所示,苦草的茎干、根系在培养前后的变化均不显著。在单种或混种培养方式下,再力花、菖蒲和梭鱼草培养后的茎干长度均显著高于培养前。长势最好的是单一种植的再力花,根、茎长度的相对生长速率为最大,且显著高于苦草和菖蒲,混合种植培养的再力花的干重相对生长速率最大。混合种植培养的美人蕉以及单一种植培养的梭鱼草最低,与其他各类植株的干重均存在显著差异。鸢尾地上和地下部分生物量的比值最大,从植物收获的可操作性方面来看,地上部分生物量的占比越大,越有利于污水净化系统通过收割地上茎叶去除氮、磷物质。因此单从植物生长状况这一层面来说,再力花、鸢尾在淮北平原区是适宜种植的湿地植物,种植梭鱼草、美人蕉对污水净化的功效相对较差。
|
|
表 1 不同水生植物试验前后生长状况 |
培养前再力花处理组中植物TN,TP积累量最高,分别为449.9,130.7 mg/m2,苦草最低。不同处理组中植物体内氮积累量均随时间推移呈现上升趋势(图 2),培养前后各组植物体内TN积累量均有显著差异;而磷积累量随时间变化不显著。培养后,苦草组的TN, TP积累量增幅最高,分别较初期增加了12.4, 1.3倍,显著高于其他挺水植物,说明沉水植物比挺水植物对污水中TP的吸收效果更好。苦草+再力花组中TN积累量、再力花组中TP积累量最大,分别为1 683.2, 173.2 mg/m2。除梭鱼草外,组合处理组与单一处理组的TN, TP积累量之间无显著差异。水生植物对污水中氮素有更好的吸附作用,对磷素的吸收效果一般;挺水植物生物量越大,对氮的吸收同化作用越好,这与周玥等[11]、Catalina等[17]的研究结果较为接近。
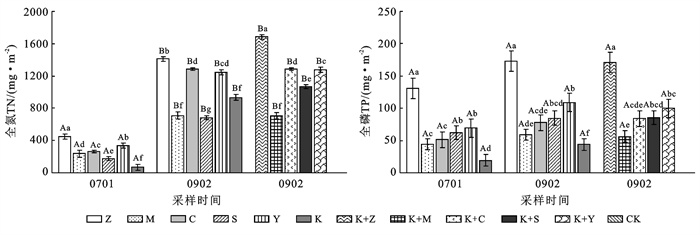
|
注:不同大写字母表示同一处理组在不同采样时间植株TN,TP积累量差异显著(p < 0.05);不同小写字母表示同一采样时间不同处理组植株TN,TP积累量差异显著(p<0.05)。 图 2 不同处理组植物中TN,TP积累量 |
不同处理组中氮磷在植株体内的分配情况见图 3。如图 3所示,培养前,再力花、梭鱼草根部的TN,TP含量显著大于茎部,含量占全部的比例分别为81.4%,74.3%和80.6%,71.0%,培养后该比例分别下降至35.7%,53.4%和27.5%,50.1%,氮、磷等养分呈现出由根部向茎叶转移的趋势。试验末期美人蕉、苦草中氮、磷的分配比例较试验开始时变化较小,养分转移变化规律并不显著,与培养期间植物的生长状态较差有关。
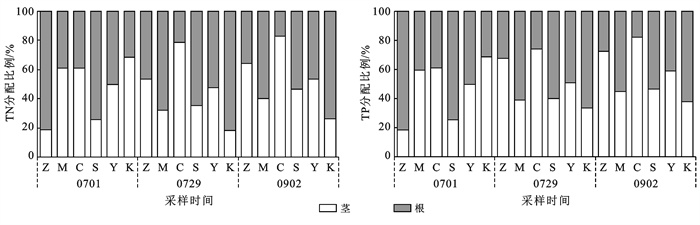
|
图 3 氮、磷在植株体内的分配特征 |
如图 4所示,试验期间底泥pH值变化范围为7.6~8.4,呈弱碱性。底泥中氮、磷含量整体呈现先上升较快后渐近平稳的变化规律。培养前底泥中TN含量在165.5~233.4 mg/kg之间,NH4+-N含量在24.6~56.3 mg/kg之间,TP变化范围在194.9~547.3 mg/kg之间。

|
注:不同大写字母表示同一处理组在不同采样时间底泥TN,NH4+-N及TP吸收量差异显著(p < 0.05);不同小写字母表示同一采样时间不同处理组底泥TN,NH4+-N及TP吸收量差异显著(p < 0. 05)。 图 4 不同处理组底泥中TN,NH4+-N及TP吸收量 |
其中美人蕉组底泥中TN, NH4+-N含量最高,苦草+菖蒲组底泥中TP含量最高。底泥TN, NH4+-N总吸收量前三的是美人蕉组、苦草+美人蕉组和苦草+菖蒲组,吸收量达到1 758.9, 1 655.1和1 541.2 mg/m2,占各组废水总脱氮量比例为30.0%, 31.5%, 25.6%;NH4+-N总吸收量前三的是梭鱼草组、美人蕉组和苦草+美人蕉组,吸收量分别为1 146.1, 1 139.1, 1 090.6 mg/m2,占氨氮总去除量的25.4%, 21.3%, 23.7%。单一种植的再力花组底泥的TN吸收量最低,鸢尾组底泥的NH4+-N吸收量最低,仅占废水氨氮总去除量的10.4%。底泥TP总吸收量前三的分别为苦草+菖蒲组、美人蕉组和梭鱼草组,苦草+鸢尾组最低。空白对照组底泥的TN,NH4+-N,TP吸收量占总脱氮量的比例分别为29.1%, 27.6%, 68.4%,其中NH4+-N和TP吸收量占比在各处理组中最高,植物生物量较大的处理组吸附比例较低。
2.4 质量平衡如表 2所示,整个水生植物处理系统中,各处理组中TN,TP的平均总拦截量分别为862.0,46.1 mg,单位面积平均去除负荷分别为85.6,4.6 mg/(m2·d)。其中,苦草组、苦草+菖蒲组TN,TP拦截量最高,鸢尾组的TN去除量最低,苦草+美人蕉组的TP去除量最低。植物吸收总氮占系统总去除量的比例在6.9%~18.3%之间,植物吸收总磷占系统总去除量的比例在4.1%~13.6%之间,与卫小松等[18]、Gaballah等[6]的结果一致,植物吸收对氮、磷去除的贡献存在一定差异,美人蕉、梭鱼草及其组合种植处理组中植物吸附量所占比例均与再力花、鸢尾等种植组差异明显。
|
|
表 2 污染物质量平衡 |
底泥吸附氮、磷占去除总量的比例范围在14.0%~31.5%和26.3%~68.4%之间,底泥吸附对TP去除的贡献明显高于对TN去除的贡献。此外,空白对照组中底泥吸附氮、磷比例基本高于其他水生植物种植组,通过污染物平衡计算的其他途径对氮、磷去除量占消纳总量的比例平均达到65.9%和53.3%,除去营养自然流失等客观因素的考虑之外,一定程度说明存在于底泥、水体等湿地系统中的微生物菌群及酶的直接、间接作用对氮磷的去除发挥着至关重要的作用[19],植物对湿地N,P去除的影响不仅直接体现在N,P吸收,更在于根系泌氧作用为微生物生长、活动提供了碳源。
3 讨论各组水生植物在生活污水中大多长势良好,经过2个多月的生长,株高增长0.4~1.5倍,根长前后变化不显著,鲜重增加0.2~1.8倍。其中再力花生物量最大,鸢尾地上和地下部分生物量的比值最大。湿地植物对N,P的吸收量与其生物量呈显著正相关[20],是降解低浓度生活污水中氮磷的主要力量。植物根系长度对净化水体的程度起着至关重要的作用[21],并且地上部分生物量的占比越大,越有利于污水净化系统通过收割地上茎叶去除氮、磷物质。因此从株高、根茎长度、鲜重等植物生物量指标以及植物收获的可操作性方面来看,再力花和鸢尾具备较强的氮、磷吸收能力,是湿地植物较为理想的选择。美人蕉在整个试验阶段株高和根长增长率最低,且后期出现枯黄现象,种植美人蕉、苦草效果相对较差,原因与当地的气候条件、试验种植采用的底泥厚度、受试水深等多方面因素有关。
湿地植物可强化填料内部微生物活动,促进根际微生物吸收、根系滞留、根际周围硝化反硝化等作用,提高脱氮除磷效果。不同水生植物及组合对TN,NH4+-N浓度的去除效果基本一致,试验初期降幅显著,水生植物主要通过系统中细菌群落的硝化和反硝化作用的连续反应实现对氮素的去除,其中植物根际细菌与TN浓度变化存在良好的正相关性[22];植物自身会吸收水中的无机氮用于体内有机氮合成[23]另一方面由于水体中有机物的降解过程也会经氨化作用转化为NH4+-N, 加之植物生长期的生物量变化, 对NH4+-N的吸收以及硝化、反硝化速率快慢差异等原因[24], 试验过程中TN及NH4+-N浓度在不同时间点略有变化。不同处理组水体TP浓度明显下降, 一方面是部分可溶性磷被植物吸收利用, 另一方面植物根系的分泌物能够促进磷的沉积、固结和吸附等物理作用[25]。本次试验中组合种植的水生植物对TP的净化比单一种植的效果更好, 搭配苦草、鸢尾的种植镶嵌组合去除率最高。此外, 水体中的磷还存在一定比例的亏损流失[26], 因此对照组TP浓度也出现了明显下降。
底泥和植物共同作用为污染物截留和降解提供载体和转化途径[27], 其对污水中污染物指标的分离富集作用主要可以分为物理吸附、离子交换和絮凝沉淀等过程[28-29]。底泥对水体中氮磷的吸附效果各有差异, 吸附量变化总体呈现出试验前期迅速增长, 而后逐渐趋于平缓的趋势。试验前期微生物结构尚未稳定, 氨化、硝化、反硝化作用强, 且植物快速生长繁殖、基质吸附未达到饱和, 因此系统的氮磷去除率逐步升高。底泥对NH4+-N的吸附作用相对较高, 大于对NO3--N的去除作用。由于底泥一般带负电荷, NH4+-N带正电荷, 因此在静电引力作用下, 底泥表面对水体中氮素的吸附以NH4+-N为主。NO3--N带负电荷不易被底泥吸附, 加之污水中自身NO3--N浓度较低, 所以各处理组底泥中NO3--N含量均较低。底泥基质对磷素的去除主要包括对不溶性磷酸盐的物理吸附以及对可溶性磷酸盐的化学沉淀等过程。底泥中TP吸附量占废水中TP总去除量的比例远远大于各类氮素吸附量的占比,说明底泥对废水中TP具有较高的吸附作用。原因主要与循环形式有关,磷元素为沉积性循环,大部分磷与矿质离子形成沉淀,沉积在底泥中[30]。此外,空白对照组底泥中氮磷积累量较多,一方面与植物生长吸收营养盐能力有关,另一方面是由于植物生长拦截作用间接影响了氮磷的沉积效果[31]。
4 结论(1) 水体中TN,NH4+-N,TP平均去除率分别达到96.6%,93.2%和95.9%,显著高于对照组。单一植物中再力花的TN去除率最高,鸢尾组、苦草+鸢尾组对TP去除率最高。整体上单一种植组与混合种植组对TN,NH4+-N的去除效果并无显著差异,而混合种植组对TP去除率略高于单一种植组。生长情况方面,再力花植株生物量最大,鸢尾地上和地下部分生物量的比值最大,梭鱼草、美人蕉干重的相对生长速率最低。
(2) 相比对磷素的吸收,水生植物对污水中氮素的有着更好的吸附效果。大型挺水植物如再力花、菖蒲等对氮的吸收同化作用更好,沉水植物比挺水植物对污水中TP的吸收效果更好。培养前后,大多挺水植物如再力花、梭鱼草等根部的TN,TP含量占比明显下降,氮、磷等养分表现出由根向茎叶转移的趋势,但美人蕉、苦草的养分迁移规律不显著。总体上,再力花、鸢尾及苦草的镶嵌组合在淮北平原区是湿地植物较为理想的选择。
(3) 底泥TN总吸收量为苦草+美人蕉组最高,再力花组最低;底泥NH4+-N总吸收量为美人蕉组最高,鸢尾组最低;底泥TP总吸收量为苦草+菖蒲组最高,苦草+鸢尾组最低。植物吸收氮、磷占系统总去除量的比例分别在4.5%~17.1%和4.1%~13.6%之间,底泥吸附氮、磷占去除总量的比例在6.9%~18.3%和26.3%~68.4%之间,底泥吸附和植物吸收对系统中氮素的去除比例均较低,而底泥对系统中磷素的去除贡献率较高。研究水生植物系统对氮磷的去除特征,除考虑控制试验过程中自然损耗的影响外,有必要对湿地系统中微生物菌群对氮磷去除的贡献率及其机制等方面进行更进一步的探讨。
| [1] |
谢东升, 朱文逸, 陈劲鹏, 等. 5种华南地区水生植物对城市生活污水的净化效果[J]. 环境工程学报, 2019, 13(8): 1903-1908. |
| [2] |
高海龙, 程寒飞, 詹茂华, 等. 太湖水生植物研究进展[J]. 湿地科学, 2019, 17(1): 9-15. |
| [3] |
Sardana A, Cottrell B, Soulsby D, et al. Dissolved organic matter processing and photoreactivity in a wastewater treatment constructed wetland[J]. Science of the Total Environment, 2019, 648: 923-934. DOI:10.1016/j.scitotenv.2018.08.138 |
| [4] |
Wang Qian, Xie Huijun, Zhang Jian, et al. Effect of plant harvesting on the performance of constructed wetlands during winter: Radial oxygen loss and microbial characteristics[J]. Environmental Science and Pollution Research, 2015, 22(10): 7476-7484. DOI:10.1007/s11356-014-3966-5 |
| [5] |
陈耀东. 中国水生植物[M]. 郑州: 河南科学技术出版社, 2012: 1-2.
|
| [6] |
Gaballah M S, Abdelwahab O, Barakat K M, et al. A novel horizontal subsurface flow constructed wetland planted with Typha angustifolia for treatment of polluted water[J]. Environmental Science and Pollution Research, 2020, 27(22): 28449-28462. DOI:10.1007/s11356-020-08669-5 |
| [7] |
Pincam T, Jampeetong A. Treatment of anaerobic digester effluent using Typha angustifolia L.: Growth responses and treatment efficiency[J]. Journal of Water and Environment Technology, 2020, 18(2): 105-116. DOI:10.2965/jwet.19-045 |
| [8] |
刘建伟, 周晓, 吕臣, 等. 三种挺水植物对富营养化景观水体的净化效果[J]. 湿地科学, 2015, 13(1): 7-12. |
| [9] |
李欢, 吴蔚, 罗芳丽, 等. 4种挺水植物、4种沉水植物及其组合群落去除模拟富营养化水体中总氮和总磷的作用比较[J]. 湿地科学, 2016, 14(2): 163-172. |
| [10] |
Rodriguez M, Brisson J. Does the combination of two plant species improve removal efficiency in treatment wetlands?[J]. Ecological Engineering, 2016, 91: 302-309. DOI:10.1016/j.ecoleng.2016.02.047 |
| [11] |
周玥, 韩玉国, 张梦, 等. 4种不同生活型湿地植物对富营养化水体的净化效果[J]. 应用生态学报, 2016, 27(10): 3353-3360. |
| [12] |
余雪花, 陈垚, 任萍萍, 等. 生物滞留系统植物筛选与综合评价[J]. 环境工程学报, 2019, 13(7): 1634-1644. |
| [13] |
张彩莹, 王妍艳, 王岩. 湿地植物齿果酸模对猪场废水净化作用研究[J]. 环境工程学报, 2011, 5(11): 2405-2410. |
| [14] |
刘明文, 孙昕, 李鹏飞, 等. 3种水生植物及其组合吸收去除水中氮磷的比较[J]. 环境工程学报, 2021, 15(4): 1289-1298. |
| [15] |
陶冶, 朱健, 李冰, 等. 基于氮、磷收支的人工湿地-池塘循环水养殖系统净化效果评价[J]. 中国海洋大学学报(自然科学版), 2021, 51(2): 36-45. |
| [16] |
Spitters C J T, Kramer T. Changes in relative growth rate with plant ontogeny in spring wheat genotypes grown as isolated plants[J]. Euphytica, 1985, 34(3): 833-847. |
| [17] |
de Los Reyes C P, Villamar C A, Neubauer M E, et al. Behavior of Typha angustifolia L. in a free water surface constructed wetlands for the treatment of swine wastewater[J]. Journal of Environmental Science and Health (Part A), 2013, 48(10): 1216-1224. |
| [18] |
卫小松, 夏品华, 袁果, 等. 湿地植物对富营养化水体中氮磷的吸收及去除贡献[J]. 西南农业学报, 2016, 29(2): 408-412. |
| [19] |
张闻涛. 洱海缓冲带对农业径流中氮磷的去除效果及机理分析[D]. 北京: 北京科技大学, 2016.
|
| [20] |
Putra R S, Cahyana F, Novarita D. Removal of lead and copper from contaminated water using EAPR system and uptake by water lettuce (Pistia stratiotes L.)[J]. Procedia Chemistry, 2015, 14: 381-386. |
| [21] |
梁奇奇, 沈耀良, 吴鹏, 等. 植物种类与水力负荷对人工湿地去除污染物的交互作用[J]. 环境工程学报, 2016, 10(6): 2975-2980. |
| [22] |
李伟斯, 李长虹, 徐斌, 等. 人工湿地植被净化水质效果及其氮磷累积研究[J]. 水土保持研究, 2018, 25(3): 250-257. |
| [23] |
詹金星, 支崇远, 夏品华, 等. 水生植物净化污水的机理及研究进展[J]. 西南农业学报, 2011, 24(1): 352-355. |
| [24] |
Güsewell S, Bollens U. Composition of plant species mixtures grown at various N: P ratios and levels of nutrient supply[J]. Basic and Applied Ecology, 2003, 4(5): 453-466. |
| [25] |
杨林, 伍斌, 赖发英, 等. 7种典型挺水植物净化生活污水中氮磷的研究[J]. 江西农业大学学报, 2011, 33(3): 616-621. |
| [26] |
徐晓锋, 史龙新, 许海, 等. 水培经济植物对污水中磷的吸收利用及去除效果[J]. 生态学杂志, 2006, 25(4): 383-388. |
| [27] |
Nguyen X C, Chang S W, Nguyen T L, et al. A hybrid constructed wetland for organic-material and nutrient removal from sewage: Process performance and multi-kinetic models[J]. Journal of Environmental Management, 2018, 222: 378-384. |
| [28] |
Yang Yan, Zhao Yaqian, Liu Ranbin, et al. Global development of various emerged substrates utilized in constructed wetlands[J]. Bioresource Technology, 2018, 261: 441-452. |
| [29] |
Listosz A, Kowalczyk-Jusko A, Józwiakowski K, et al. Productivity and chemical properties of Salix viminalis in a horizontal subsurface flow constructed wetland during long-term operation[J]. Ecological Engineering, 2018, 122: 76-83. |
| [30] |
董佳, 田相利, 董双林, 等. 三疣梭子蟹和凡纳滨对虾混养系统的氮磷收支的研究[J]. 中国海洋大学学报(自然科学版), 2013, 43(12): 16-24. |
| [31] |
杨忠臣. 人工湿地植物根系泌氧和分泌物影响污染物去除的机制研究[D]. 山东济南: 山东大学, 2016.
|
 2021, Vol. 41
2021, Vol. 41 

