2. 陇东学院 生命科学与技术学院, 甘肃 庆阳 745000;
3. 陕西师范大学 生命科学学院, 陕西 西安 710119;
4. 甘肃省极端环境微生物资源与工程重点 实验室, 中国科学院 寒区旱区环境与工程研究所 甘肃 兰州 730000;
5. 西安环发环保工程有限公司, 陕西 西安 710068
2. College of Life Science and Technology, Longdong University, Qingyang, Gansu 745000, China;
3. College of Life Science, Shaanxi Normal University, Xi'an, Shaanxi 710119, China;
4. Key Laboratory of Extreme Environmental Microbial Resources and Engineering of Gansu Province, Cold and Arid Regions Environmental and Engineering Research Institute, Chinese Academy of Sciences, Lanzhou, Gansu 730000, China;
5. Xi'an H & F Environment Protection Engineering Company Limited, Xi'an, Shaanxi 710068, China
现已成为全国第一大油田的长庆油田公司是陇东地区社会经济发展的主要支柱产业。但在石油开采、贮存以及运输过程中已造成该地区原油污染土壤面积1.02×104 hm2[1],其中庆阳市北部地区土壤总石油烃(TPH)含量已高达79 634.37±2 614.15 mg/kg,高出土壤油污临界值近400倍,那么如何实现当地社会经济快速发展与环境保护之间双赢的目标就显得尤为重要,因此陇东黄土高原地区油污土壤的生态修复工作已成为该地区环境治理领域的首要问题。
植物修复法以其环境友好、成本低、操作性强和生态可承受性好等特点近年来备受青睐[2],植株修复通常以吸附、转化和特定污染物超级累的方式为基础,通过提升根际微生物及其根系分泌物的共代谢水平,将土壤中持久性有机污染物吸附、分解、清除或转变成为无毒物质[3]。但植物修复技术通常受植物超级累特性和地域适生性双重限制[4],而陇东地区干旱少雨、土壤贫瘠、盐碱化程度高、寒暑及昼夜温差大,因此该地区植被分布具有明显地域性[5]。目前有关油污土壤植物修复技术的相关报告多集中在陕西、新疆、山东和黑龙江等地,且植物品种主要包括黑麦草(Lolium perenne)、油菜(Brassica chinensis)、狗尾草(Setaria viridis)、沙打旺(Astragalus adsurgens)、紫花苜蓿(Medicago sativa)和草木犀(Melilotus officinalis)等[6-9],而有关陇东地区油污土壤植物生态修复工作相关报道则相对较少[10]。
为此,本研究拟以紫花苜蓿(Medicago sativa)、金盏菊(Calendula officinalis)、非洲菊(Gerbera jamesonii)和白三叶草(Trifolium repens)这4种陇东适生品种为受试植物,在甘肃省庆阳市马岭镇长庆油田采油二厂“陇东油泥处理站”试验田开展为期3个月的场地生态修复试验,分析不同油污浓度胁迫下4种陇东适生植物根际土壤总石油烃(TPH)降解率、TPH富集(BCF)和转移系数(TF)、根际TPH降解菌数量以及5种植物生长指标响应情况,旨在为陇东地区开展油污土壤植物场地生态修复技术提供新的植物品种和基础数据参考。
1 材料与方法 1.1 场地修复样地选择和试验设置场地修复试验在甘肃省庆阳市马岭镇长庆油田采油二厂“陇东油泥处理站”进行(东经107°22′19″,北纬36°36′15″)。本次试验油污来源为清罐油泥(TPH=489 764.62±896.11 mg/kg),为最大程度模拟陇东黄土高原地区常见土壤油污浓度,在清罐油泥中配置了部分清洁自然风干土(源自为井场周边撂荒地,含水量为1.94±0.62%),使其对应的总石油烃(TPH)终浓度分为3个等级,分别为轻度污染(10 000 mg/kg)、中度污染(40 000 mg/kg)和重度污染(70 000 mg/kg),浇水平衡10 d后测得TPH含量依次为(9 641.64±184.17)mg/kg,(39 117.18±151.42)mg/kg和(68 794.75±187.34)mg/kg,以不加油泥的井场周边撂荒地清洁土壤为空白对照组(TPH=0 mg/kg),文中以设置浓度为标识。
由西安环发环保工程有限公司负责修建束沿池,深度为50 cm,大小为2 m×3 m,土层铺设厚度为25~30 cm。每个油污浓度设置1组对照和4组处理,分别为CK组、紫花苜蓿组、非洲菊组、金盏菊组和白三叶草组,每组设3个重复,共计45个束沿修复池。试验开始于2017年4月6日,结束于2017年7月5日,试验周期为91 d,在相应束沿内播种供试植物种子150~250粒〔根据前期试验结果,白三叶草在TPH为40 000 mg/kg时出苗率为(48.21±14.97)%,其余3种适生植物出苗率介于(79.93±19.08)%~(85.97±18.57)%之间,因而每种受试植物播种量据此增减,使每个束沿池内植株个数保持在150~200株之间,植株密度介于35~45株/m2〕,覆土厚度约为1 cm,由于清罐油泥中沥青类物质含量较高致使油污土壤板结严重,为防止油泥淤积在表层覆土及外部渗漏[10],使之土壤田间持水量保持在60%~70%[11]。
1.2 样品采集及测定方法修复期结束后,4种供试植物对应束沿池内随机收获50株供试植物根际土壤样品,以5份根际土样合并为1份土样,共计10个重复[12],采用超声—索氏萃取—重量法测定土壤及植物体总石油烃含量[13],土壤石油烃降解菌数量则采用最大或然数(MPN)法[14];采用山宝琴等[3]的方法测定株高和根长,地上和地下部分干重及其根冠比采用程丽娟等[14]的测定方法。
1.3 数据处理与计算利用IBM SPSS Statistics19.0和R2.15.2 (http://www.r-project.org/)对数据进行分析,用Origin 8.0和R 2.15.2作图。方差分解运用“Vegan”数据包里的“Varpart”功能对本研究所测定9项指标进行方差分解,所有数据均经过Hellinger转换,用Venn图表示生长指标,TPH转移效率及土壤石油降解菌数量对其根际土壤TPH降解率的纯效应以及共同效应,图中的数字代表上述指标对4种受试植物根际土壤TPH降解情况的信息解释率[4]。
2 结果与分析 2.1 4种供试植物根际土壤TPH降解率与日平均降解速率变化情况图 1为场地修复过程中4种供试植物根际TPH降解率变化情况。F检验结果显示,轻度污染时紫花苜蓿和金盏菊根际TPH降解率相对较高(p < 0.05);而中度污染时白三叶草根际TPH降解率明显低于其他3种受试植物(p < 0.05);当油污浓度增至70 000 mg/kg时,4种供试植物根际TPH降解率依次为金盏菊>非洲菊>紫花苜蓿>白三叶草(p < 0.05)。而不同油污浓度胁迫下4种植物根际TPH降解率变化情况亦不尽相同(F紫花苜蓿=118.274,F非洲菊=9.320,F金盏菊=4.706,F白三叶草=233.603,p < 0.01)。与轻度污染组相比,紫花苜蓿和白三叶草根际TPH降解率在中度污染时分别下降了(6.81±0.94)%和(10.02±1.05)%(p < 0.05),而金盏菊和非洲菊处理组则分别上升了(3.14±0.29)%和(2.11±0.72)%,说明两种豆科植物对油污浓度在增加相对敏感,但当油污浓度增至70 000 mg/kg时,4种植物根际TPH降解率依次分别下降了(41.97±2.62)%,(12.54±1.91)%,(10.49±2.53)%和(48.11±3.31)%(p < 0.05),相较之下重度石油污染对紫花苜蓿和白三叶草的根际TPH降解率抑制程度最为明显,其根际TPH降解率仅为(33.78±1.22)%和(11.72±1.51)%。
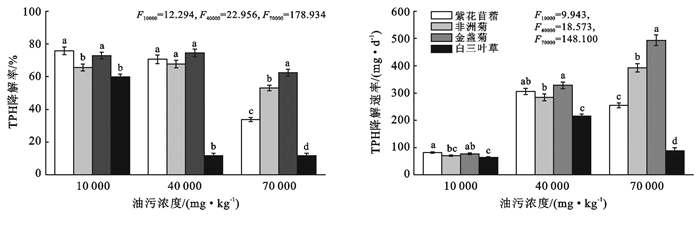
|
图 1 场地修复过程中4种供试植物根际土壤TPH降解率与日平均降解速率变化情况(p < 0.01,α=0.05) |
然而,前人研究指出生物修复过程中土壤TPH生物转化效率强弱可通过TPH日平均降解速率予以表征[9],且在植物修复过程中亦为反映植物根际营养元素有效化及共代谢水平高低的重要指标[5]。为此,本研究分析了不同油污浓度胁迫下4种供试植物根际TPH日平均降解速率的变化情况(图 1)。与植物根际TPH降解率变化情况不同的是金盏菊和非洲菊根际土壤TPH降解速率随油污浓度增加逐步上升(R非洲菊2=0.91,R金盏菊2=0.94,p < 0.01),说明本研究所设置的3个油污浓度在一定程度上可促进二者根际土壤TPH转化效率。由此可见,油污浓度的增加对植物根际土壤TPH降解率可产生显著抑制作用,但其根际TPH降解速率的响应方式则因种而异。
2.2 不同油污浓度胁迫下4种供试植物处理组土壤TPH富集和转移情况油污土壤植物修复过程中可采用生物转移系数(TF)和生物富集系数(BCF)来表征植物对石油烃的转化和吸收程度[15],因此本研究分析比较了不同油污浓度胁迫下4种供试植物TPH的转移和富集系数变化情况(表 1)。首先,4种供试植物TF系数和BCF系数均相对较低,说明其TPH转移和富集相对低下,原因可能在于修复期相对较短以及石油烃生态毒性双重影响[16],而清罐油泥中含量相对较高的沥青类物质会严重抑制植物生物量的积累[17]。其次,轻度污染时金盏菊最高、非洲菊次之,而TF系数则为金盏菊最高、紫花苜蓿次之(p < 0.05);中度和重度污染时菊科植物根际BCF系数均显著高于两种豆科植物(表 1),而TF系数在中度污染时依次为金盏菊>非洲菊>紫花苜蓿>白三叶草(p < 0.05)。此外,4种受试植物TF系数在重度污染时的响应情况来看,菊科植物TPH转移效率优于豆科植物,而重度污染对豆科植物修复效果的影响主要体现在抑制其根际TPH的有效转移,由此说明不同品种植物间TPH转移效率是决定其根际TPH降解率的主要因素。
|
|
表 1 场地修复过程中不同油污浓度胁迫下4种供试植物土壤TPH的转移和富集系数变化情况 |
前人研究指出应用于油污土壤生态修复的植物应具备生物量大、抗逆性强和生长迅速等特点[5],为此本研究分析比较4种供试植物在不同油污浓度胁迫下生物量变化情况(表 2)。首先,白三叶草株高、根长、地上部及地下部干重和根冠比均随油污浓度的增加而明显降低(p < 0.05),说明石油污染对其正常生长产生了严重影响,结合其根际TPH转移及富集系数试验结果,可基本确定在陇东地区重度油污土壤场地生态修复过程中不应单独选用白三叶草。其次,由表 2可见重度污染可显著抑制紫花苜蓿和非洲菊株高但却明显促进了金盏菊株高的生长(p < 0.05)。随着油污浓度的增加非洲菊和金盏菊根长逐渐降低,而紫花苜蓿根长则显著增加(p < 0.05),说明当油污浓度≥40 000 mg/kg时可能对该地区紫花苜蓿根长具有一定促进作用。此外,紫花苜蓿根冠比在中度污染时达到最高,但重度污染时明显低于非洲菊和金盏菊(p < 0.05),原因在于其地上部干重在中度污染时受到抑制所致(表 2)。此外,随着油污浓度增加非洲菊根冠比逐渐降低,但金盏菊根冠比则随之上升(p < 0.05)。
|
|
表 2 不同油污浓度胁迫下4种供试植物生长指标变化情况 |
前已述及植物根际营养元素有效化及共代谢水平高低是决定土壤TPH降解效率的重要指标[18],而植物根际功能性土壤微生物数量是决定土壤TPH降解过程中的关键生物学环境因素[19],为此本研究测定了场地修复过程中不同油污浓度胁迫下4种供试植物根际土壤石油烃降解菌数量变化情况(表 3)。就同一油污浓度而言,4种供试植物根际土壤烷烃降解菌数量在轻度和重度污染时依次为金盏菊>非洲菊>紫花苜蓿>白三叶草(p < 0.05),而中度污染则为金盏菊最高,紫花苜蓿次之(p < 0.05),说明同一油污浓度胁迫下4种受试植物根际烷烃降解菌数量因种而异,且无论在何种油污浓度胁迫下金盏菊根际烷烃降解菌数量均为最高。与烷烃降解菌数量相似的是4种植物根际土壤芳烃降解菌数量在中度污染时依次为金盏菊>非洲菊>紫花苜蓿>白三叶草(p < 0.05),而不同之处在于金盏菊和非洲菊在轻度和重度污染组间其根际土壤芳烃降解菌数量无显著差异。
|
|
表 3 场地修复过程中不同油污浓度胁迫下4种供试植物根际土壤石油烃降解菌数量变化情况 |
其次,由表 3可见紫花苜蓿根际土壤烷烃降解菌数量依次为中度污染组>轻度污染组>重度污染组>CK组,而白三叶草处理组则依次为轻度污染组>中度污染组>重度污染组>CK组,2种菊科植物根际土壤烷烃降解菌数量则在不同油污浓度时无显著差异但均远高于CK组,说明重度污染会显著抑制豆科植物根际烷烃降解菌数量,而菊科植物根际烷烃降解菌数量则受油污浓度的影响相对较小。
2.5 场地修复过程中影响4种供试植物根际土壤TPH降解率的因子方差分解为了明确场地修复过程中植物生长指标、土壤TPH转移效率以及根际土壤石油降解菌数量对4种供试植物根际土壤TPH降解率的影响情况,将本研究所测定的9组与根际土壤TPH降解率密切相关的土壤环境以及植物指标进行了方差分解(图 2)。根据方差分解残差(Residuals)可知,3类指标总叠加效应分别解释了4种供试植物根际土壤TPH降解率68.11%,72.44%,79.47%和60.37%的信息量。
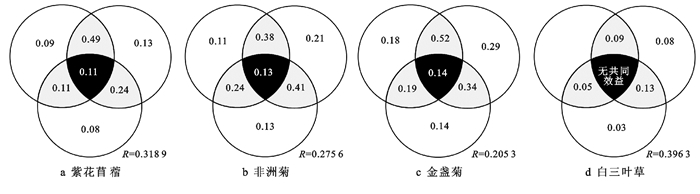
|
注:方差分解残差R值小于0者在图中未显示。 图 2 场地修复过程中影响4种供试植物根际土壤TPH降解率的因子方差分解Venn特征 |
由图 2a可见,植物生长指标、TPH转移效率和石油降解菌数量分别解释了紫花苜蓿根际土壤TPH降解率的18%,29%和14%的信息量,而植物生长指标×石油降解菌数量的交互效应共同解释了49%的信息量,但3类指标综合叠加效应仅解释了紫花苜蓿根际土壤TPH降解率11%的信息量,说明3类指标均不同程度参与了紫花苜蓿根际土壤TPH的生物降解,其中植物生长指标和石油降解菌数量的共同作用对紫花苜蓿根际土壤TPH降解率影响相对较大。
从2种菊科植物根际土壤TPH降解率的因子方差分解结果来看(图 2b和2c),3类指标均不同程度参与了对非洲菊和金盏菊根际土壤TPH的生物降解,其中石油降解菌数量×TPH转移效率(41%)以及植物生长指标×石油降解菌数量(52%)是决定两种菊科植物根际TPH降解率的决定性因素。而白三叶草的根系土壤分析结果显示(图 2d),其植物生长指标由于石油烃生态毒性限制对其根际TPH降解率无显著影响,而石油降解菌数量×TPH转移效率(13%)的交互效应是决定其根际土壤TPH降解效果的关键环境因素。
3 讨论 3.1 场地修复过程中4种适生植物生长指标对不同油污浓度的响应油污土壤植物生态修复技术通常受植物特性、污染程度以及土壤环境等多种因素的影响,其中植物对土壤TPH特定组分的富集转移和根际土壤微生物对TPH的生物降解作用是植物生态修复的理论基础[20]。通常情况下应用于油污土壤生态修复的植物应具备生物量大、抗逆性强和生长迅速等特点[5]。山宝琴等[3]分析比较了不同浓度原油污染胁迫下6种陕北适生豆科植物的生长差异,结果显示轻度污染(5 000 mg/kg)对受试植物株高有促进作用,但随着油污浓度由10 000增至40 000 mg/kg时,6种受试植物株高均受到明显抑制;而黄建等[9]在分析探讨不同油污浓度对4种新疆盐生植物生长特性的影响时指出油污浓度在5 000 mg/kg时可增加盐生植物的株高,但随着污染物浓度的增大供试植物株高受到显著抑制;程立娟等[14]通过温室盆栽试验探讨了不同油污浓度对野生观赏植物长药八宝生长指标的影响,结果显示中度污染可有效增加长药八宝的根长,但重度污染对其根长有明显抑制作用,这与本研究试验结果基本一致,但金盏菊株高以及紫花苜蓿根长的试验结果与上述试验结论有所不同,究其原因可能是由于轻度污染对金盏菊株高的影响相对较小,植物体可通过体内代谢有效降低了石油烃的生态毒性[5],因而在轻度污染时其株高与CK组间无显著差异;而重度污染胁迫时金盏菊植物抗逆性随之增加,植物体代谢过程中将TPH有效降解生成CO2和H2 O并产生能量,而这些物质和能量则可用于自身的生长,进而导致株高和根长的增加[21]。此外,油污土壤植物修复过程中植物根际区是生物降解的主要场所[22],且植物根冠比通常与其根际TPH降解率间呈正相关关系[17]。本研究中4种受试植物根际TPH降解率在不同油污浓度间的变化趋势(图 1)与其根冠比变化趋势(表 2)已存在显著正相关关系(R2=0.83,p < 0.01),究其原因在于不同油污浓度胁迫下紫花苜蓿根冠比明显低于非洲菊和金盏菊,由于中度和重度污染可促进紫花苜蓿地下部干重的同时其地上部干重在中度污染时受到抑制所致(表 2),而中度和重度污染对金盏菊地上部干重的抑制作用进而引起了金盏菊根冠比的增加。
3.2 场地修复过程中4种适生植物根际原油降解菌数量对不同油污浓度的响应植株修复通常以吸附、转化和特定污染物超级累的方式为基础,通过提升根际微生物及其根系分泌物的共代谢水平,将土壤中持久性有机污染物吸附、分解、清除或转变成为无毒物质[5],因此植物修复过程中植物根际土壤微生物数量高低是决定其修复效果的主要生物学环境因子[4]。本研究中所设置的3组油污浓度影响下两种豆科植物在重度污染时显著受抑,但菊科植物根际烷烃降解菌数量则受油污浓度的影响相对较小(表 3),说明相较于豆科植物,陇东地区石油污染土壤植物修复时菊科植物耐受力相对更强,这与沈伟航等[23]研究指出不同植物对石油污染耐受力不尽相同的研究结论相一致。原因可能是由于不同植物根际分泌物差异导致了与根际微生物共代谢水平有所差异[24];其次,中低油污浓度(≤50 000 mg/kg)时土壤TPH为土著石油降解菌提供了丰富的碳源,有助于土壤石油降解数量的提升[25],而重度污染会破坏土壤结构,增加植物根际土壤粘度进而抑制土壤透气性[18],加之严重的碳氮比失衡,进而抑制土壤微生物数量和活性[1]。此外,本研究中相同油污浓度胁迫下4种供试植物根际烷烃降解菌数量亦存在显著差异,但无论在何种油污浓度胁迫下金盏菊根际土壤烷烃和芳烃降解菌数量均为最高(表 3),可能是由于金盏菊根际土壤微环境种根际分泌物为土壤微生物的氮源、无机盐及生长因子等含量相对较高[26],进而有效提升其根际土壤微生物数量和活性[27],加速了根际土壤TPH去除率和降解速率。
3.3 场地修复过程中4种供试植物根际TPH降解率对不同油污浓度的响应油污土壤植物场地生态修复通常受到物种本身生物学特性和原油污染的双重影响,其中不同油污浓度影响下土壤TPH降解率是直接反映和评价植物修复效果的重要指标[7]。李先梅等[28]以紫花苜蓿为试验材料在华北油田开展了为期70 d的原位修复试验,结果显示随着油污浓度增加,其TPH降解率由69%降至10%。程立娟等[14]研究表明植物根际TPH降解率与土壤油污浓度间呈显著负相关关系。本研究4种供试植物根际TPH降解率均随土壤油污浓度的增加而降低,紫花苜蓿、非洲菊和金盏菊在轻度和中度污染时其根际TPH降解率无显著差异但在重度污染时明显受到下降(图 1),原因在于重度污染会增加植物根际土壤黏度[4],降低根际微环境通透性[29],阻碍营养物质的有效循环[14]和生理功能[16],进而限制了植物根际持久性有机污染物矿化效率[15],导致根际TPH降解率逐渐逐步。
此外,本研究轻度污染时紫花苜蓿和白三叶草根际TPH降解速率明显低于中度和重度污染组(p < 0.05),而非洲菊和金盏菊根际TPH降解速率则与油污浓度间呈正相关关系(R非洲菊2=0.91,R金盏菊2=0.94,p < 0.01),原因可能是由于不同植物品种对油污浓度的敏感程度不尽相同[8],如白三叶草在重度污染时出现大面积枯萎和死亡,说明随着油污浓度增加石油烃生态毒性逐步积累进而造成其抗氧化酶系和细胞膜结构的损伤[17],限制了植物正常生理功能所致[27],因此植物生长指标对其根际土壤TPH降解率无显著影响(图 2d)。而两种菊科植物根际TPH降解速率则与油污浓度间呈正相关关系,且两种植物根际石油降解菌数量×TPH转移效率以及植物生长指标×石油降解菌数量对其根际土壤TPH降解率的影响程度均相对较高(图 2b和2c),则直接说明菊科植物应对油污浓度的抗性相对较强,植物体对TPH转移程度以及根际微环境土壤石油降解菌对TPH有效分解是决定两种菊科植物根际TPH降解率优于豆科植物的主要因素,因此上述结果也说明非洲菊和金盏菊是陇东地区油污土壤场地生态修复较理想的植物品种。
4 结论(1) 土壤油污浓度增加对豆科植物根际土壤TPH降解率的抑制作用更为显著,且主要体现在对豆科植物根际TPH有效转移的抑制作用。
(2) 油污浓度增加对紫花苜蓿、非洲菊和白三叶草株高和根长可产生显著抑制作用,但重度污染对金盏菊株高和根长具有明显促进作用的同时对其根际石油降解菌数量无显著影响。
(3) 石油降解菌数量×TPH转移效率以及植物生长指标×石油降解菌数量的交互作用是决定两种菊科植物根际TPH降解率的关键因素。
综上所述,4种受试植物各项指标对陇东地区油污土壤场地生态修复的响应方式因种而异,但重度油污土壤场地生态修复过程中不应单独选用白三叶草,而两种菊科植物油污耐受性和修复效果相对较好,因此在该地区具备一定的应用潜力。
| [1] |
王金成, 井明博, 段春燕, 等. 石油烃污染对陇东黄土高原土壤生物学及非生物学特性的影响[J]. 水土保持通报, 2017, 37(1): 9-16. |
| [2] |
Schwitzguébel J P. Phytoremediation of soils contaminated by organic compounds: Hype, hope and facts[J]. Journal of Soils and Sediments, 2017, 17(5): 1492-1502. |
| [3] |
山宝琴, 张永涛, 曹巧玲, 等. 6种陕北适生豆科植物生长对原油污染土壤的响应[J]. 环境科学, 2014, 35(4): 1125-1130. |
| [4] |
王金成, 周天林, 井明博, 等. 陇东黄土高原地区石油污泥原位修复过程中土壤主要肥力指标动态变化分析[J]. 环境科学学报, 2015, 35(1): 280-287. |
| [5] |
王金成, 井明博, 段春艳, 等. 陇东黄土高原石油污染土壤环境因子对金盏菊(Calendula officinalis)-微生物联合修复的响应[J]. 环境科学学报, 2015, 35(9): 2971-2981. |
| [6] |
高彦征, 凌婉婷, 朱利中, 等. 黑麦草对多环芳烃污染土壤的修复作用及机制[J]. 农村环境科学学报, 2005, 24(3): 498-502. |
| [7] |
张敏, 梁红, 高大文, 等. 东北地区23种杂草对多环芳烃超积累特性研究[J]. 环境科学, 2011, 32(10): 3088-3093. |
| [8] |
祁迎春, 王建, 王宏, 等. 陕北7种杂草种子对石油污染的耐受性研究[J]. 环境科技, 2014, 27(3): 5-14. DOI:10.3969/j.issn.1674-4829.2014.03.002 |
| [9] |
黄建, 田长彦, 卞卫国, 等. 4种盐生植物生长对土壤石油污染的响应[J]. 干旱区研究, 2014, 31(1): 100-104. |
| [10] |
张松林, 董庆士, 周喜滨, 等. 人为石油污染土壤紫花首藉田间修复试验[J]. 兰州大学学报, 2008, 44(1): 47-50. |
| [11] |
陈立, 张发旺, 刘少玉, 等. 中原油田石油污染土壤原位生物修复技术试验研究[J]. 环境工程学报, 2011, 10(5): 2385-2390. |
| [12] |
向言词, 冯涛, 刘炳荣, 等. 植物修复对锰尾渣污染土壤特性的影响[J]. 水土保持学报, 2007, 21(6): 79-82. DOI:10.3321/j.issn:1009-2242.2007.06.018 |
| [13] |
王如刚, 王敏, 牛晓伟, 等. 超声-索氏萃取-重量法测定土壤中总石油烃含量[J]. 分析化学, 2010, 38(3): 417-420. |
| [14] |
程立娟, 周启星. 野生观赏植物长药八宝对石油烃污染土壤的修复研究[J]. 环境科学学报, 2014, 34(4): 980-986. |
| [15] |
张麟君, 李凯荣, 张晓阳. 陕北黄土高原不同植物对石油污染物的吸收与积累[J]. 西北农林科技大学学报:自然科学版, 2013, 41(8): 110-116. |
| [16] |
于君宝, 阚兴艳, 王雪宏, 等. 黄河三角洲石油污染对湿地芦苇和碱蓬幼苗生长影响的模拟研究[J]. 地理科学, 2012, 32(10): 1254-1260. |
| [17] |
弓晓峰, 荣亮, 杨丽珍, 等. 石油污染土壤对玉米生长的影响及其生态毒性研究[J]. 环境科学与技术, 2011, 34(10): 71-75. DOI:10.3969/j.issn.1003-6504.2011.10.016 |
| [18] |
Tang Jingchun, Wang Rugang, Niu Xiaowei, et al. Enhancement of soil petroleum remediation by using a combination of ryegrass(Lolium perenne)and different microorganisms[J]. Soil & Tillage Research, 2009, 110(1): 87-93. |
| [19] |
Sun Weimin, Dong Yiran, Gao Pin, et al. Microbial communities inhabiting oil-contaminated soils from two major oilfields in Northern China: Implications for active petroleum-degrading capacity[J]. Journal of Microbiology, 2015, 53(6): 371-378. |
| [20] |
Roman M, Lukasz C, Agnieszka P C, et al. Rhizosphere as a tool to introduce a soil isolated hydrocarbon degrading bacterial consortium into a wetland environment[J]. International Biodeterioration & Biodegradation, 2015, 97: 135-142. |
| [21] |
Proffitt C E. Effects of oil on mangrove seedling grown under different environmental conditions[J]. Marine Pollution Bulletin, 1995, 30(12): 788-795. |
| [22] |
Getter C D, Ballou T G, Koons C B. Effects of dispersed oil on mangrove synthesis of a seven-year study[J]. Marine Pollution Bulletion, 1985, 16(8): 318-324. DOI:10.1016/0025-326X(85)90447-3 |
| [23] |
沈伟航, 朱能武, 王华金, 等. 石油污染土壤生物修复过程中毒性的植物指示[J]. 农业环境科学学报, 2015, 34(1): 22-28. |
| [24] |
杨艳, 凌婉婷, 高彦征, 等. 几种多环芳烃的植物吸收作用及其对根系分泌物的影响[J]. 环境科学学报, 2010, 30(3): 593-599. |
| [25] |
Escobar A L F, Vaca M, López R, et al. Hydrocarbon degradation andlead solubility inasoil polluted withlead andused motor oil treated bycomposting andphytoremediation[J]. Bulletin of Environmental Contamination and Toxicology, 2018, 100(2): 280-285. |
| [26] |
王亚男, 程立娟, 周启星. 萱草修复石油烃污染土壤的根际机制和根系代谢组学分析[J]. 环境科学, 2016, 37(5): 1978-1985. |
| [27] |
雒晓芳, 陈丽华, 杨成波, 等. 植物-微生物联合修复石油污染土壤的实验室模拟[J]. 兰州大学学报, 2015, 51(3): 411-417. |
| [28] |
李先梅, 肖易, 吴芸紫, 等. 华北油田石油污染土壤的修复植物筛选[J]. 环境科学与技术, 2015, 38(6): 14-19. |
| [29] |
李小利, 刘国彬, 薛萐, 等. 土壤石油污染对植物苗期生长和土壤呼吸的影响[J]. 水土保持学报, 2007, 21(3): 95-98. DOI:10.3321/j.issn:1009-2242.2007.03.022 |
 2019, Vol. 39
2019, Vol. 39 
